
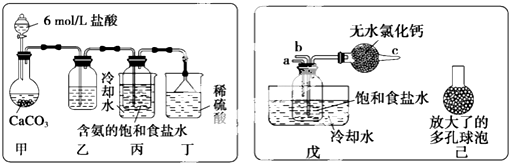
分析 工业上侯氏制碱法是在饱和食盐水中通入氨气和二氧化碳,由于氨气在水中的溶解度大,所以先通入氨气,通入足量的氨气后再通入二氧化碳,生成了碳酸氢钠,由于碳酸氢钠的溶解度较小,所以溶液中有碳酸氢钠晶体析出,将碳酸氢钠晶体加热后得纯碱碳酸钠,
Ⅰ.依据题干中信息碳酸氢钠溶解度相对较小分析,所以在饱和食盐不通入氨气和二氧化碳后,碳酸氢钠晶体会析出;
(Ⅱ)(1)a.盐酸是易挥发性酸,在制取二氧化碳时常会含有氯化氢气体,要除去氯化氢可以用饱和碳酸氢钠溶液,盐酸与碳酸氢钠反应生成二氧化碳,且二氧化碳在碳酸氢钠溶液中溶解度很小,据此答题;
b.实验过程中氨气可能有剩余,稀硫酸能吸收氨气;
c.分离固体与液体采用过滤的方法;
(2)a.根据氨气易溶于水,从制取碳酸氢钠时先要得到含氨的饱和食盐水分析解答;
b.根据图可知,装置改动后反应物的接触面积变大,提高了二氧化碳的吸收率;
(3)氢氧化钠溶液里通入过量CO2生成碳酸氢钠.
解答 解:工业上侯氏制碱法是在饱和食盐水中通入氨气和二氧化碳,由于氨气在水中的溶解度大,所以先通入氨气,通入足量的氨气后再通入二氧化碳,生成了碳酸氢钠,由于碳酸氢钠的溶解度较小,所以溶液中有碳酸氢钠晶体析出,将碳酸氢钠晶体加热后得纯碱碳酸钠,
Ⅰ.a.碳酸氢钠易溶于水,故错误;
b.碳酸氢钠受热易分解,与其在溶液中首先结晶析出无关,故错误;
c.碳酸氢钠的溶解度相对于氯化铵来说碳酸氢钠的溶解度更小一些,所以在溶液中首先结晶析出,故正确;
故选c;
Ⅱ.(1)a.用盐酸制取二氧化碳时,因盐酸易挥发,所以,二氧化碳中常会含有氯化氢气体,碳酸氢钠能与盐酸反应不与二氧化碳反应,所以通过碳酸氢钠的溶液是可以除掉二氧化碳气体中的氯化氢气体,
故答案为:饱和碳酸氢钠溶液;
b.实验过程中氨气可能有剩余,而稀硫酸能与氨气反应,所以稀硫酸的作用是吸收末反应的NH3,
故答案为:吸收未反应的NH3;
c.分离出NaHCO3晶体的操作是分离固体与液体,常采用的实验操作是过滤操作,
故答案为:过滤;
(2)a.制取碳酸氢钠时先要得到含氨的饱和食盐水,氨气极易溶于水,二氧化碳能溶于水,所以应先通入氨气,所以a端通入,从而保证了从b通入二氧化碳时,二氧化碳被充分反应,
故答案为:a;NH3;b;CO2;
b.装置改动后反应物的二氧化碳与溶液的接触面积变大,提高了二氧化碳的吸收率,
故答案为:增大气体与溶液接触面积,提高CO2吸收率;
(3)碳酸钠溶液里通过量的CO2能生成碳酸氢钠,在烧碱溶液里通入过量CO2也能生成碳酸氢钠,故答案为:往烧碱溶液中通入过量CO2(或往饱和Na2CO3溶液中通入CO2过量等).
点评 本题主要考查“侯氏制碱法”的反应原理、设计制备实验的设计,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握实验原理以及物质的性质,难度中等题.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 将等体积的①、②溶液混合后,盐酸会抑制醋酸的电离,所以pH>2 | |
| B. | 将一定体积的②、③溶液混合后,溶液显碱性,则该混合溶液中c(Cl-)>c(NH4+) | |
| C. | 将一定体积的①、④溶液混合后,溶液显酸性,则V(NaOH)可能等于V(CH3COOH) | |
| D. | 向等体积的③、④溶液中加水稀释10倍,稀释后溶液中由水电离的c(H+):③>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫及其化合物有广泛应用.
硫及其化合物有广泛应用.| NH3•H2O | H2SO3 | ||
| 电离平衡常数为 (mol•L-1) | 1.7×10-5 | Ka1 | Ka2 |
| 1.54×10-2 | 1.02×10-7 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com