

| 2 |
| 2.2 |
| 10 |
| 11 |
| 2 |
| x |
| 2.2 |
| 2.8 |
| 2×2.8 |
| 2.2 |
| 28 |
| 11 |
| 28 |
| 11 |
| 5 |
| 11 |
| 5 |
| 11 |
| 10 |
| 11 |
| 5 |
| 11 |


科目:高中化学 来源: 题型:
| A、福岛核电站泄露的放射性物质131I与127I互为同位素,化学性质几乎相同 |
| B、电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述 |
| C、凡是中心原子采取sp3杂化方式成键的分子其几何构型都是正四面体 |
| D、钠原子L层共有8种运动状态不同的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
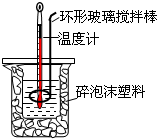 测定中和热实验装置如图:
测定中和热实验装置如图:| 温度实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
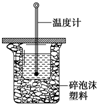 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com