
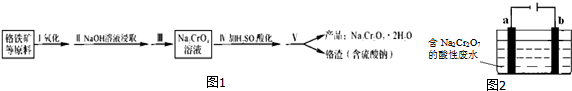
分析 铬铁矿(主要成分:FeO•Cr2O3,还含有少量的Al2O3)氧化后亚铁离子被氧化为铁离子,铬离子被氧化为+4价Na2CrO4,加入氢氧化钠溶液浸取,铁离子沉淀,氧化铝溶解生成偏铝酸钠,通过调节溶液PH,NaAlO2等杂质可以以沉淀的形式除去,水浸过滤后得到Na2CrO4溶液,加入硫酸酸化反应为:2Na2CrO4+H2SO4?Na2SO4+Na2Cr2O7+H2O,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体,
(1)Cr元素为24号元素,原子核外有24个电子,根据核外电子排布规律书写,价电子排布式为外围电子排布式;
(2)化学反应中有化合价升降的反应是氧化还原反应,还原剂是在反应中所含元素化合价升高的反应物,还原剂中化合价升高的元素被氧化,依据化学方程式4FeO•Cr2O3+8Na2CO3+7O2=2Fe2O3+8Na2CrO4+8CO2,分析反应过程中元素化合价变化,计算电子转移总数得到;
(3)步骤II中加入NaOH溶液时氧化铝和氢氧化钠反应生成溶于水的偏氯酸钠和水,以便通过调PH以沉淀形式除去;
(4)a连接电源负极,所以a为阴极,连接石墨;b连接电源正极,所以b为电解槽的阳极;阳极铁发生氧化反应,根据铬元素守恒分析计算.
解答 解:(1)Cr元素为24号元素,原子核外有24个电子,所以核外电子排布式为:1s22s22p63s23p63d54s1,它的外围电子排布式是3d54s1,
故答案为:3d54s1;
(2)步骤I中反应的化学方程式为:4FeO•Cr2O3(s)+8Na2CO3(s)+7O2(g)═8Na2CrO4(s)+2Fe2O3(s)+8CO2(g),元素的化合价变化为:4个Fe由+2→+3,8个Cr由+3→+6,28个O由0→-2,转移28e-,化合价升高的元素被氧化,所以反应中被氧化的元素是Fe、Cr(或铁、铬),生成2mol Fe2O3时转移电子的物质的量为28mol,
故答案为:Fe、Cr(或铁、铬);28;
(3)步骤II中加入NaOH溶液时氧化铝和氢氧化钠反应:2NaOH+Al2O3=2NaAlO2+H2O,除去氧化铝,NaAlO2等杂质可以以沉淀的形式除去,水浸过滤后得到Na2CrO4溶液,
故答案为:2NaOH+Al2O3=2NaAlO2+H2O;
(4)根据电解槽图示可知,a为阴极,a电极的电极材料是石墨,溶液显示酸性,溶液中氢离子得到电子,发生还原反应,电极反应为:2H++2e-=H2↑,b为阳极,铁失去电子生成亚铁离子,亚铁离子被Cr2O72-氧化成铁离子,反应的方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,含Cr2O3为50%的铬铁矿30.4kg,含Cr2O3质量为30.4×106×50%g,流程中铬元素的利用率为80%,根据铬元素守恒,则最终能制得Na2Cr2O7•2H2O:$\frac{30.4×1{0}^{6}×50%}{152g/mol}$×80%=23.84kg,
故答案为:石墨;Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;23.84.
点评 本题考查了重铬酸钠制备的流程分析判断,物质性质和实验操作的分析应用,掌握电解原理、氧化还原反应原理、物质的分离提纯方法是解题关键,题目难度中等,侧重于考查学生的实验能力、分析问题、解决问题的能力.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
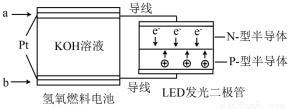
| A. | P一型半导体连接的是电池负极 | |
| B. | b 处通入O2为电池正极,发生了还原反应 | |
| C. | 通入O2的电极发生反应:O2+4e-+4H+=2H2O | |
| D. | 该装置只涉及两种形式的能量转换 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙炔 | B. | 2-丁炔 | C. | 1-丁烯 | D. | 2-甲基丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数是3 | B. | 质子数是3 | C. | 中子数是1 | D. | 电子数是2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
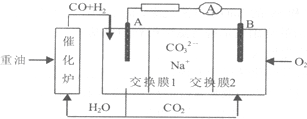
| A. | 重油是石油分馏的产品,含有的主要元素为C、H、O | |
| B. | 电极B上发生的电极反应为:O2+2CO2+4e-═2CO32- | |
| C. | 电极A上H2参与的电极反应为:H2+2OH--2e-═2H2O | |
| D. | 电池工作时,CO32-向电极B移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
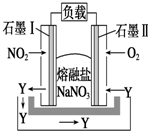 熔融盐NaNO3组成的燃料电池如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,下列有关说法正确的是( )
熔融盐NaNO3组成的燃料电池如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,下列有关说法正确的是( )| A. | 石墨Ⅰ极为正极,石墨Ⅱ极为负极 | |
| B. | Y的化学式可能为NO | |
| C. | 石墨Ⅰ极的电极反应式为NO2+NO${\;}_{3}^{-}$-e-═N2O5 | |
| D. | 石墨Ⅱ极上发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com