
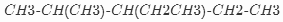 的名称是2-甲基-3-乙基戊烷.
的名称是2-甲基-3-乙基戊烷. .
.分析 (1)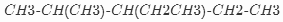 为烷烃,主链有5个碳原子,从左端编号,2号碳上有1个甲基,3号碳上有1个乙基,据此书写名称;
为烷烃,主链有5个碳原子,从左端编号,2号碳上有1个甲基,3号碳上有1个乙基,据此书写名称;
(2)羟基由一个氧原子和一个氢原子构成,氧原子最外层6个电子,氢原子最外层一个电子,二者形成一个共用电子对;
(3)设烷烃的分子式为CxH(2x+2),根据相对分子质量为72,列出方程式进行计算x值,支链越多,沸点越低.
解答 解:(1)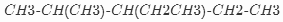 为烷烃,主链有5个碳原子,从左端编号,2号碳上有1个甲基,3号碳上有1个乙基,据其系统命名为:2-甲基-3-乙基戊烷;
为烷烃,主链有5个碳原子,从左端编号,2号碳上有1个甲基,3号碳上有1个乙基,据其系统命名为:2-甲基-3-乙基戊烷;
故答案为:2-甲基-3-乙基戊烷;
(2)从羟基的中心原子O周围7个电子,羟基中存在一对共用电子对,羟基的电子式为 ,
,
故答案为: ;
;
(3)设烷烃的分子式为CxH(2x+2),
则14x+2=72,解得x=5,所以该烷烃的分子式为C5H12,分子式为C5H12的同分异构体有主链有5个碳原子的:CH3CH2CH2CH2CH3,
主链有4个碳原子的:CH3CH(CH3)CH2CH3,
主链有3个碳原子的:CH3C(CH3)2CH3;
支链越多,沸点越低,故CH3C(CH3)2CH3,
故答案为:CH3C(CH3)2CH3.
点评 本题考查了等电子式、有机化合物的命名,题目难中等,注意掌握常见化学用语的表示方法,把握有机物的官能团的性质以及相关结构简式的书写方法,掌握有机物的命名原则是解题关键.


科目:高中化学 来源: 题型:选择题
| A. | 终点溶液偏碱性 | B. | 终点溶液中c(NH4+)=c(Cl-) | ||
| C. | 终点溶液中氨过量 | D. | 合适的指示剂是甲基橙而非酚酞 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
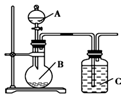 某研究性学习小组根据元素非金属性与其最高价氧化物对应的水化物之间的关系,设计了如图装置来一次性完成S、C、Si的非金属性强弱比较的实验研究,下列关于试剂B选择正确的是( )
某研究性学习小组根据元素非金属性与其最高价氧化物对应的水化物之间的关系,设计了如图装置来一次性完成S、C、Si的非金属性强弱比较的实验研究,下列关于试剂B选择正确的是( )| A. | 稀H2SO4 | B. | Na2SO4溶液 | C. | Na2CO3溶液 | D. | Na2SiO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石>晶体桂>碳化硅 | B. | Na>Mg>Al | ||
| C. | NaF<NaCl<NaBr | D. | CI4>CBr4>CCl4>CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
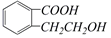 的有机物可以通过不同的反应得到下列四种物质:
的有机物可以通过不同的反应得到下列四种物质:
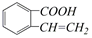

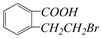
| A. | 取代、消去、酯化、加成 | B. | 取代、消去、加聚、取代 | ||
| C. | 酯化、取代、缩聚、取代 | D. | 酯化、消去、氧化、取代 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,两份相同质量的铁粉,分别与足量的稀硫酸和稀硝酸反应,产生气体的体积相同 | |
| B. | 非金属氧化物不一定是酸性氧化物,金属氧化物多数是碱性氧化物 | |
| C. | 活性炭、SO2、Na2O2都能使品红溶液褪色,但原理不同 | |
| D. | 将CO2气体通入BaCl2溶液中至饱和未见沉淀生成,继续通入NO2则有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:| 方法I | 用碳粉在高温条件下还原CuO |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
| 方法III | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
| 序号 | Cu2O a克 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | 方法II | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | 方法III | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | 方法III | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用KI溶液除去FeCl2溶液中的Fe3+ | B. | 用饱和NaHCO3溶液除去Cl2中的HC1 | ||
| C. | 用金属钠鉴别1一丁醇和2一丁醇 | D. | 用溴水鉴别苯和己烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com