
【题目】硼镁泥是硼镁矿生产硼砂晶体(Na2B4O7·10H2O)时的废渣,其主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3 、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取的七水硫酸镁在印染、造纸和医药等工业上都有广泛的应用。硼镁泥制取七水硫酸镁的工艺流程如下:

回答下列问题:
(1)Na2B4O7·10H2O中B的化合价为________________。
(2)Na2B4O7易溶于水,也较易发生水解:B4O72-+7H2O![]() 4H3BO3(硼酸)+2OH-,(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:_________________________________。
4H3BO3(硼酸)+2OH-,(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:_________________________________。
(3)滤渣B中含有不溶于稀盐酸但能溶于浓盐酸的黑色固体,写出生成黑色固体的离子方程式_________________。
(4)加入MgO的目的是_____________________。
(5)己知MgSO4、CaSO4的溶解度如下表:
温度(℃) 溶解度(g) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
操作“A”是将MgSO4:和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明“操作A”步骤为____________________。
(6)Na2B4O7·10H2O失去全部结晶水后的硼砂与金属钠、氢气及石英砂一起反应可制备有机化学中的“万能还原剂——NaBH4”(该过程B的化合价不变)。
①写出NaBH4的电子式_____________。
②“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力。NaBH4的有效氢含量为_____(计算结果保留两位小数)。
③在碱性条件下,在阴极上电解NaBO2也可制得硼氢化钠,写出阴极室的电极反应式_______________。
【答案】 +3 Na2B4O7+H2SO4+5H2O= Na2SO4+H3BO3↓ ClO- +Mn2++H2O=MnO2+Cl-+2H+ 调节溶液的pH值,使Fe3+转化为氢氧化铁沉淀除去 蒸发浓缩、趁热过滤 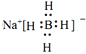 0.21 BO2-+6H2O+8e-= BH4-+8OH-
0.21 BO2-+6H2O+8e-= BH4-+8OH-
【解析】硼镁泥主要成份是MgO,还有CaO、Al2O3、Fe2O3、FeO、MnO、B2O3、SiO2等杂质,加入硫酸,MgO、CaO、Al2O3、Fe2O3、FeO、MnO、B2O3都和硫酸反应,SiO2不与硫酸反应,次氯酸钠具有强氧化性,加入的NaClO可与Mn2+反应生成MnO2,把亚铁离子氧化成铁离子,加MgO调节pH,溶液pH升高,铁离子生成氢氧化铁沉淀,铝离子形成氢氧化铝沉淀,过滤,滤渣B含有Fe(OH)3、Al(OH)3、MnO2,蒸发浓缩滤液,趁热过滤,滤渣C为硫酸钙晶体,滤液中含镁离子,除钙后,只剩镁离子,蒸发冷却结晶得到硫酸镁晶体。
(1)Na2B4O710H2O中,钠的化合价+1价,氧元素化合价-2价,元素化合价代数和为0计算得到B的化合价为:2×(+1)+4x+(-2)×7=0,x=+3,故答案为:+3;
(2)Na2B4O7易溶于水,也较易发生水解:B4O72-+7H2O![]() 4H3BO3(硼酸)+2OH-,(硼酸在常温下溶解度较小)。在Na2B4O7溶液中加入硫酸,会促进水解,反应生成硼酸,反应的化学方程式为Na2B4O7+H2SO4+5H2O= Na2SO4+H3BO3↓,故答案为:Na2B4O7+H2SO4+5H2O= Na2SO4+H3BO3↓;
4H3BO3(硼酸)+2OH-,(硼酸在常温下溶解度较小)。在Na2B4O7溶液中加入硫酸,会促进水解,反应生成硼酸,反应的化学方程式为Na2B4O7+H2SO4+5H2O= Na2SO4+H3BO3↓,故答案为:Na2B4O7+H2SO4+5H2O= Na2SO4+H3BO3↓;
(3)滤渣B中含有不溶于稀盐酸但能溶于浓盐酸的黑色固体,NaClO溶液在加热条件下将溶液中的Mn2+氧化成MnO2,生成黑色固体的离子方程式为:ClO-+Mn2++H2O=MnO2+Cl-+2H+,故答案为:ClO-+Mn2++H2O=MnO2+Cl-+2H+;
(4)加入MgO的目的是调节溶液的pH值,使Fe3+转化为氢氧化铁沉淀除去,故答案为:调节溶液的pH值,使Fe3+转化为氢氧化铁沉淀除去;
(5)有温度对硫酸镁、硫酸钙的溶解度影响,温度越高,硫酸钙溶解度越小,可以采用蒸发浓缩,趁热过滤方法除去硫酸钙;操作I”是将滤液继续蒸发浓缩,冷却结晶,再经过过滤,便得到了MgSO47H2O,故答案为:蒸发浓缩(结晶);趁热过滤;
(6) ①NaBH4属于离子化合物,电子式为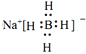 ,故答案为:
,故答案为: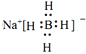 ;
;
②每克含氢还原剂的还原能力相当于多少克H2的还原能力,则NaBH4变化为H+,电子转移8e-,电子转移和氢气变化为氢离子电子转移相同,设NaBH4的质量为1g,相当于氢气质量为x,计算为: ![]() ×8=
×8=![]() ×2,解得:x=0.21g,故答案为:0.21;
×2,解得:x=0.21g,故答案为:0.21;
③在阴极上电解NaBO2也可制得硼氢化钠,则阴极室BO2-得电子发生还原反应生成BH4-,则电极反应式为:BO2-+6H2O+8e-=BH4-+8OH-,故答案为:BO2-+6H2O+8e-=BH4-+8OH-;


科目:高中化学 来源: 题型:
【题目】化学与生产、生舌密切相关,下列说法正确的是
A. 维生素D可促进人体对钙自吸收
B. 可以直接用淀粉溶液检验海水中是否含碘元素
C. 有机玻璃的主要成分是硅酸盐
D. 石油的分馏过程主要涉及化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、质量数为293的超重元素,该元素原子核内的中子数和核外电子数之差为( )
A. 175 B. 47 C. 118 D. 57
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫烟气(主要成分为SO2)的处理备受关注,主要有以下两种方法。请回答:
I .碱液吸收法
步骤1:用足量氨水吸收SO2
步骤2:再加入熟石灰,发生反应2NH4++Ca2++2OH-+SO32-=CaSO3↓+2NH3·H2O
(1)步骤1中反应的离子方程式为_______________________。
(2)已知:25°C时,Ksp(CaSO3)=b,步骤2中反应的平衡常数K=a。该温度下,Kb( NH3·H2O)=__________________(用含a、b的代数式表示)。
II.水煤气还原法
己知:①2CO(g)+SO2(g)![]() S(l)+2CO2(g) △H1=-37.0 kJ·mol-1
S(l)+2CO2(g) △H1=-37.0 kJ·mol-1
②2H2(g)+ SO2(g)![]() S(l)+2H2O(g) △H2=+45.4 kJ·mol-1
S(l)+2H2O(g) △H2=+45.4 kJ·mol-1
③CO的燃烧热△H3=-283 kJ·mol-1
(3)1molS(l)在O2(g)中完全燃烧生成SO2(g)的热化学方程式为____________。
(4)反应②的正反应的活化能为E1 kJ·mol-1,其逆反应的活化能E2=_____ kJ·mol-1。
(5)在一定压强下,发生反应②。平衡时,α(SO2)与原枓气投料比[![]() ]和温度(T) 的关系如图所示。
]和温度(T) 的关系如图所示。

①α(H2):N_____M (填“>”、“<”或 “ = ”)。
②逆反应速率:M_____Q(填“>”、“<”或 “ = ”)。
(6)t℃时,向10L恒容密闭容器中充入2 molCO(g)、2 mol SO2(g)和2 mol H2(g)。发生反应①和反应②。5mim达到平衡时,SO2(g)和CO2(g) 的物质的量分别为0.4mol、1.6mol。该温度下,反应②的平衡常数K=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁易被氧化而变质。为检验某补血剂中硫酸亚铁是否变质,可向该补血剂配成的溶液中加入
A.硝酸和硝酸银溶液B.盐酸酸化的BaCl2溶液
C.KSCN溶液D.硝酸酸化的Ba(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列实验数据判断正确的是( )
①用100mL的量筒量取16.80mL的液体
②用托盘天平称取12.50gKCl固体
③中和滴定操作时,消耗0.1000mol/L的H2SO423.0mL
④用广泛pH试纸测得某溶液的pH=3.4
A. ①④正确 B. ①③正确 C. ④正确 D. ①②③④全错
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值。下列有关叙述正确的是
A. pH=1的硫酸溶液中含有的SO42-数目为0.05NA
B. 100g质量分数为46%的乙醇溶液中所含的氢原子数为12NA
C. 100mL 1mol/L CH3COONH4 溶液中含有的NH4+数目为0.1NA
D. 0.2molNH3与0.3molO2在催化剂的作用下加热充分反应,所得NO的分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列组成细胞的化合物与其功能不符的是
A. 无机盐——维持细胞的渗透压
B. 葡萄糖——细胞主要的能源物质
C. 蛋白质——生命活动的主要体现者
D. 脱氧核糖核酸——所有生物的遗传物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
Ⅰ、现有下列5种有机物:①CH2 = CH2 ②CH3 C≡CH ③CH3CH2CH2OH
④CH3 O CH2CH3 ⑤![]()
请回答:
(1)属于烃类的是____________(填序号,下同),与①互为同系物的是___________,与③互为同分异构体的是____________.
(2)用系统命名法给⑤命名,其名称为_________________________.
Ⅱ、(1)分子式为C4Hl0O的同分异构体共有____________种;
(2)分子式为C3H6O2的链状有机物,核磁共振氢谱上峰的数目及强度比分别为:①3∶3;②2∶2∶1∶1,则它们可能的结构简式依次为:
①_______________________;② ________________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com