
【题目】下列有关叙述正确的是( )
A.1 L0.6molL﹣1的食盐水中含氯化钠0.6mol
B.0.5mol碳酸钠溶于水配成0.5L溶液,所得溶液的物质的量浓度为0.5molL﹣1
C.标准状况下,44.8L氯化氢气体溶于1L水中所得溶液的物质的量浓度为2molL﹣1
D.20g氢氧化钠溶于水配成物质的量浓度为1molL﹣1的溶液,可得溶液1L
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】山梨酸是一种常用的酸性防腐剂,其结构简式为CH3CH===CHCH===CH—COOH,下列不属于山梨酸具有的性质的是 ( )
A.能与Br2发生加成反应
B.能与乙醇发生酯化反应
C.易与空气中的O2发生氧化反应
D.能在NaOH溶液作用下发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学化学兴趣小组学生在学习“含硫化合物的性质和应用”时,进行了如下实验探究:为了验证浓硫酸和碳在加热的情况下反应的生成物,用图Ⅰ装置进行实验。

(1)请写出碳与浓硫酸反应的化学反应方程式_________________________________;该反应中氧化剂与还原剂的物质的量之比为_____________;
(2)图Ⅰ中A处是完成实验中的必要装置,它是下图所示中的_________;(填编号)
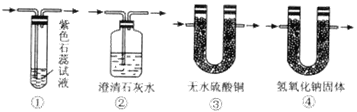
(3)图Ⅰ中C装置中应盛的试剂最好为:足够的_______________,其作用是__________________;
(4)若出现_______________________ 的实验现象,则可以确定存在二氧化碳气体。
(5)现实验小组的同学继续进行实验,他们将二氧化硫和氯气按一定的比例同时通入品红溶液中,一段时间后,发现品红溶液没有褪色。试分析实验过程中,品红不褪色的原因___________________(用离子反应方程式表示);你认为怎么样做可以让品红的颜色越来越浅?_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】称取铁粉和氧化铜的混合物6.40g,进行如下实验:
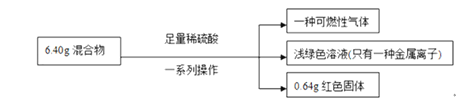
根据实验所得数据,完成下列填空:
(1)原混合物中氧化铜的质量能否确定?____________(填“能”或“不能”),若能确定,则氧化铜的质量为_________;
(2)上述过程中生成气体的名称为_________;(折算为标准状况下)的体积为__________ ;
(3)实验中参加反应的硫酸的物质的量为____________;
(4)原混合物中铁的质量分数为 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列框图分析.下列说法正确的是( ) 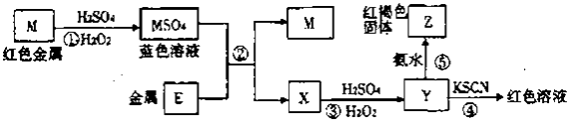
A.E2+的氧化性比M2+的氧化性弱
B.在反应①中硫酸既表现了酸性、又表现了氧化性
C.反应④的离子方程式可表示为:3SCN﹣+E3+=E(SCN)3↓
D.在③反应中若不加稀硫酸可能看到红褐色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是( )
A. 铝粉与NaOH溶液反应:Al + 2OH-===AlO![]() + H2↑
+ H2↑
B. SiO2和NaOH溶液反应:SiO2+ 2OH-===SiO![]() + H2O
+ H2O
C. 氯化铵浓溶液跟浓NaOH溶液混合后加热:NH![]() +OH-
+OH-![]() NH3·H2O
NH3·H2O
D. 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH![]() +OH-
+OH-![]() NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com