
| 选项 | 实验事实 | 结论 |
| A | 将SO2通入含HClO的溶液中生成H2SO4 | HClO的酸性比H2SO4强 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | 稀、浓硝酸分别与铜反应,还原产物分别为NO和NO2 | 稀硝酸氧化性比浓硝酸强 |
| D | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.甲是浓氨水,乙是浓硫酸 |
| B.甲是浓盐酸,乙是浓氨水 |
| C.甲是浓氨水,乙是浓盐酸 |
| D.甲是浓硝酸,乙是浓氨水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.非金属元素R所形成的含氧酸盐(NaROb)中的R元素必定呈现正价 |
| B.只有非金属能形成含氧酸或含氧酸盐 |
| C.除稀有气体外的非金属元素都能生成不同价态的含氧酸 |
| D.非金属的最高价含氧酸都具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硅主要以单质、氧化物、硅酸盐的形式存在于自然界中 |
| B.青铜是我国使用最早的合金,钢是用量最大、用途最广泛的合金 |
| C.铁容器可以盛放浓盐酸、浓硝酸、浓硫酸 |
| D.漂白粉、漂粉精可用来漂白棉、麻、纸张,不能用作游泳池及环境的消毒剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
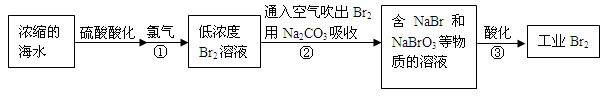
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.与NaOH反应的氯气一定为0.15 mol |
| B.当反应中被氧化的氯元素和被还原的氯元素之比为1:4时,溶液中NaClO和NaClO3的物质的量之比为3:1 |
| C.溶液中n(Na+):n(Cl-)可能为7:3 |
| D.若Cl2与NaOH的反应中转移的电子为n mol,则0.15<n<0.35 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.气体甲一定不是SO2 | B.气体甲一定是Cl2 |
| C.气体甲一定不是发生了化合反应 | D.气体甲一定被溶液乙氧化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 操作 | 现象 |
| 取适量漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝,后褪色 |
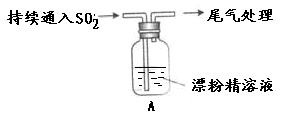 | 液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com