
 氢气是清洁能源,也是重要的化工原料.
氢气是清洁能源,也是重要的化工原料.分析 (1)钠和水反应生成氢氧化钠和氢气;
(2)根据已知方程式构建目标方程式结合盖斯定律来分析;
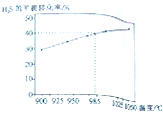
(3)①根据在985℃时,H2S的转化率为40%,即可求出H2S的物质的量的该变量,然后根据在反应中,物质的量的该变量之比等于计量数之比,即可求出S2的物质的量的该变量,然后根据v=$\frac{△n}{\frac{V}{△t}}$来计算反应速率.
②据图可知,温度越高,H2S的平衡转化率越高,则说明升高温度,反应H2S=H2(g)+$\frac{1}{2}$S2(g)平衡右移,反应吸热,据此判断.
解答 解:(1)钠和水反应生成氢氧化钠和氢气,反应方程式为:2Na+2H2O=H2↑+2NaOH,故答案为:2Na+2H2O=H2↑+2NaOH;
(2)已知:N2(g)+3H2(g)=2NH3(g)△H=-92.40kJ•mol-1 ①
2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-86.98kJ•mol-1 ②
将①+②可得:N2(g)+3H2(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=(-92.4KJ/mol)+(-86.98KJ/mol)=-179.38KJ/mol,
故答案为:N2(g)+3H2(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-179.38KJ/mol;
(3)①在985℃时,H2S的转化率为40%,H2S的物质的量的该变量△n=3.5mol×40%=1.4mol,在反应中,物质的量的该变量之比等于计量数之比,故S2的物质的量的该变量△n=0.7mol,故反应速率v(S2)=$\frac{△n}{\frac{V}{△t}}$=$\frac{0.7mol}{\frac{2L}{7min}}$=0.05mol/(L•min),
故答案为:0.05mol/(L•min);
②据图可知,温度越高,H2S的平衡转化率越高,则说明升高温度,反应H2S=H2(g)+$\frac{1}{2}$S2(g)平衡右移,反应吸热,故反应S2(g)+2H2(g)=2H2S(g)放热,即△H<0,
故答案为:<.
点评 本题考查了钠与水反应、反应热的计算、反应热的计算等知识,利用盖斯定律进行反应热的计算以及利用温度对平衡转化率的影响来分析反应吸热还是放热是解答关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
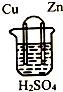
| A. | 铜片作正极,锌片作负极 | |
| B. | 该电池工作时,锌失电子变为Zn2+进入溶液 | |
| C. | 该电池工作时,电子由铜片流向锌片 | |
| D. | 该电池工作时,H+在铜片上得电子被还原生成H2逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-+H2O?HCO3-+OH- 热的纯碱溶液清洗油污 | |
| B. | Al3++3H2O?Al(OH)3 (胶体)+3 H+ 明矾净水 | |
| C. | TiCl4+(x+2)H2O(过量)?TiO2•x H2O+4HCl 用TiCl4制备TiO2 | |
| D. | SnCl2+H2O?Sn(OH)Cl+HCl 配制氯化亚锡溶液时应加入氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙酸互为同分异构体 | |
| B. | 乙醇、乙酸都能与钠反应 | |
| C. | 乙醇、乙酸都能与NaOH溶液反应 | |
| D. | 乙醇、乙酸都能使紫色石蕊试液变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铝、铁是两种重要的金属元素,其单质及化合物在生产生活中的应用日趋广泛.
铝、铁是两种重要的金属元素,其单质及化合物在生产生活中的应用日趋广泛.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com