

| 仪器代号 | 所装试剂 | 装置作用 |
| A | 石灰石和 | 制取CO2证明硝酸比碳酸强 |
| C | ||
| 仪器代号 | 所装试剂 | 装置作用 |
| 1 mol/L硝酸 | ||
| 饱和碳酸氢钠溶液 | 除去CO2中的硝酸蒸气 | |
| C | 硅酸钠溶液 | 证明碳酸强于硅酸 |


科目:高中化学 来源: 题型:
| A、葡萄糖 | B、味精 |
| C、高级脂肪酸 | D、氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaO+H2O═Ca(OH)2 | ||||
B、Fe2O3+3CO
| ||||
C、CaCO3
| ||||
| D、CO2+2NaOH═Na2CO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
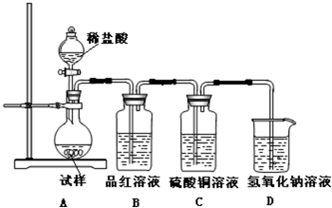
查看答案和解析>>
科目:高中化学 来源: 题型:
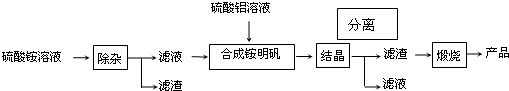
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验现象 | 实验结论 | |
| 猜想 | 在一支洁净的试管中加入适量的上述淡黄色粉末,再加入足量的蒸馏水 | 猜想a、c不成立,猜想b成立. | |
| 探究 | ①用带火星的木条伸入过氧化钠与水反应的试管中 | 木条复燃 | 生成物有 |
| ②往①试管内的溶液中滴加 | 生成物有氢氧化钠 |
| 实验操作 | 实验现象 | 实验结论 |
| ①将CO2从a口处通入装置内,充分反应后,再把带火星的木条放入收集满气体的集气瓶b中 | 木条复燃 | CO2在常温下能与过氧化钠反应,该反应的化学方程式为: |
| ②取出充分反应后的固体生成物于试管中,往试管内滴加稀盐酸,将生成的气体通入澄清石灰水中 | 有气泡产生;石灰水变浑浊 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com