
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由单质A转化为单质B时△H=+119 kJ/mol 可知单质B比单质A稳定 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含l mol NaOH的溶液混合,放出的热量大于57.3kJ | |
| D. | 在101kPa时,H2燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol,则H2在101kPa时的燃烧热为571.6kJ/mol |
分析 A、硫蒸气变化为硫固体为放热过程;
B、能量越高越不稳定;
C、浓硫酸溶解放热,和氢氧化钠的反应是放热反应;
D、燃烧热是1mol可燃物完全燃烧生成最稳定的产物所释放的热量.
解答 解:A、硫蒸气变化为硫固体为放热过程,则等量的硫蒸气和硫固体在氧气中分别完全燃烧,放出热量硫蒸气多,即前者放出热量多,故A错误;
B、由单质A转化为单质B,△H=+119KJ/mol,可知单质A的能量低,而能量越低物质越稳定,故B错误;
C、浓硫酸溶解时放热,0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ,故C正确;
D、燃烧热是1mol氢气燃烧生成液态水放出的热量,故D错误.
故选C.
点评 本题考查了反应热量变化,热化学方程式的正误判断,物质能量与稳定性的比较方法,题目难度中等.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
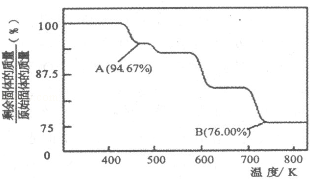 铬是用途广泛的金属,但在生产过程中易产生有害的含铬工业废水.
铬是用途广泛的金属,但在生产过程中易产生有害的含铬工业废水.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
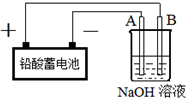 Cu2O是一种半导体材料,实验室用铅酸蓄电池电解一定浓度的NaOH溶液制备Cu2O,方程式为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑装置如图所示,回答下列问题
Cu2O是一种半导体材料,实验室用铅酸蓄电池电解一定浓度的NaOH溶液制备Cu2O,方程式为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑装置如图所示,回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ①②③⑤ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(SO42-)≈c(CrO42-) | B. | c(SO42-)>c(CrO42-) | C. | c(SO42-)<c(CrO42-) | D. | 无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com