用7.5g有杂质的锌粒和足量的稀盐酸反应生成标况下1.12L氢气,求锌粒的纯度(锌粒中杂质与稀盐酸不反应)?在标况下向收集到的氢气中通入一定量的氧气,充分反应后测得在相同条件下剩余气体0.28L,求通入氧气在标况下的体积?
【答案】
分析:利用氢气的体积计算其物质的量,然后利用锌与盐酸反应的化学方程式来计算锌的物质的量,再计算其纯度;氢气与氧气反应时,剩余气体可能为氢气,也可能为氧气,然后利用氢气与氧气反应的化学方程式来计算.
解答:解:氢气的物质的量为

=0.05mol,
设锌的物质的量为x,则
Zn+2HCl═ZnCl
2+H
2↑
1 1
x 0.05mol
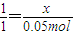
,解得x=0.05mol,
则锌的质量为0.05mol×65g/mol=3.25g,
则锌粒的纯度为
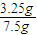
×100%=43.33%,
剩余气体的物质的量为
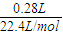
=0.0125mol,
若剩余气体为氢气,则反应的氢气的物质的量为0.05mol-0.0125mol=0.0375mol,
由2H
2+O
2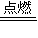
2H
2O,则氧气的体积为0.0375mol×

×22.4L/mol=0.42L,
若剩余气体为氧气,则氧气的物质的量为0.05mol×

+0.0125mol=0.0375mol,
则氧气的体积为0.0375mol×22.4L/mol=0.84L,
答:锌粒的纯度为43.33%;当氧气少量时其体积为0.42L,当氧气过量时其体积为0.84L.
点评:本题考查学生利用化学反应方程式的计算,明确氢气的物质的量代入计算即可解答,分析氧气的体积时应考虑两种可能是解答的关键,也是学生容易出错的地方.

 =0.05mol,
=0.05mol,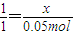 ,解得x=0.05mol,
,解得x=0.05mol,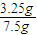 ×100%=43.33%,
×100%=43.33%,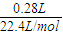 =0.0125mol,
=0.0125mol, 2H2O,则氧气的体积为0.0375mol×
2H2O,则氧气的体积为0.0375mol× ×22.4L/mol=0.42L,
×22.4L/mol=0.42L, +0.0125mol=0.0375mol,
+0.0125mol=0.0375mol,

 一线名师提优试卷系列答案
一线名师提优试卷系列答案