
 脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源.
脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源.
| ||
| a |
| a |
| a |
 ,故答案为:
,故答案为: .
.

 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
(07年重庆卷)(14分)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源。
(1)硫化氢与 FeCl3 溶液反应生成单质硫,其离子方程式为 _______ 。
(2)用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫、其电解总反应方程式(忽略氧的氧化还原)为 ____ ;该方法的优点是______ 。
(3)一定温度下1 mol NH4 HS固体在定容真空容器中可部分分解为硫化氢和氨气。
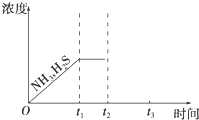
①当反应达平衡时p氨气×p硫化氢=a(Pa2),则容器中的总压为______ Pa;
②题图是上述反应过程中生成物浓度随时间变化的示意图。若t2时增大氨气的浓度且在t3时反应再次达到平衡,请在图上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为 。
(2)用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫,其电解总反应方程式(忽略氧的氧化还原)为 ;该方法的优点是 。
(3)一定温度下1 mol NH4 HS固体在定容真空容器中可部分分解为硫化氢和氨气。
①当反应达平衡时ρ氨气×p硫化氢=a(Pa2),则容器中的总压为 Pa;
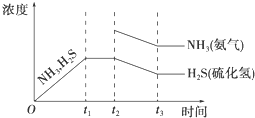
②题26图是上述反应过程中生成物浓度随时间变化的示意图。若t2时增大氨气的浓度且在t3时反应再次达到平衡,请在图上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线.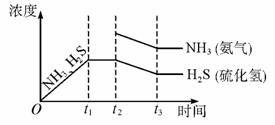
题26图
查看答案和解析>>
科目:高中化学 来源: 题型:
脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源。
(1)硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为_______________________________________。
(2)用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫,其电解总反应方程式(忽略氧的氧化还原)为 ______________________________;
该方法的优点是____________________________________。
(3)一定温度下,1 mol NH4HS固体在定容真空容器中可部分分解为硫化氢和氨气。
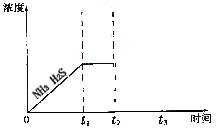
①当反应达平衡时p(NH3)×p(H2S) = a(Pa2),则容器中的总压为_____________Pa;
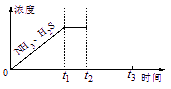
②如图是上述反应过程中生成物浓度随时间变化的示意图。若t2时增大氨气的浓度且在t3时反应再次达到平衡,请在图上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线。
查看答案和解析>>
科目:高中化学 来源:2007年普通高等学校招生全国统一考试(重庆卷)理综化学部分 题型:填空题
(14分)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源.
(1)硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为 .
(2)用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫、其电解总反应方程式(忽略氧的氧化还原)为 ;该方法的优点是 .
(3)一定温度下1 mol NH4 HS固体在定容真空容器中可部分分解为硫化氢和氨气.
①当反应达平衡时ρ氨气×p硫化氢=a(Pa2),则容器中的总压为 Pa;
②题26图是上述反应过程中生成物浓度随时间变化的示意图.若t2时增大氨气的浓度且在t3时反应再次达到平衡,诸在图上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线.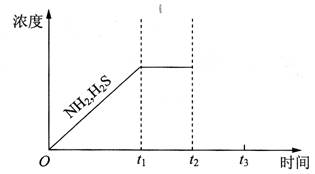
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com