
 某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如图所示:
某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如图所示:| 纯A(单质) | B溶液 | D固体 | G溶液 | |
| 颜色 | 银白色 | 棕黄色 | 红棕色 | 浅绿色 |
分析 E为密度最小的气体是H2;G为浅绿色溶液说明含有Fe2+;B为棕黄色溶液,说明含有Fe3+,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,说明含有氯离子,所以B为FeCl3.B能将某种氧化物氧化为F,说明该氧化物具有还原性,F是含有三种元素的化合物,能反应生成氢气,所以该氧化物是二氧化硫,故F为H2SO4,G为FeSO4.A、B、C、D、G含有同种元素,A为银白色单质,转化得到氯化铁,可知A为Fe,D是红棕色固体,由转化关系可知,D为Fe2O3,C为Fe(OH)3,据此解答.
解答 解:E为密度最小的气体是H2;G为浅绿色溶液说明含有Fe2+;B为棕黄色溶液,说明含有Fe3+,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,说明含有氯离子,所以B为FeCl3.B能将某种氧化物氧化为F,说明该氧化物具有还原性,F是含有三种元素的化合物,能反应生成氢气,所以该氧化物是二氧化硫,故F为H2SO4,G为FeSO4.A、B、C、D、G含有同种元素,A为银白色单质,转化得到氯化铁,可知A为Fe,D是红棕色固体,由转化关系可知,D为Fe2O3,C为Fe(OH)3.
(1)D的化学式:Fe2O3,故答案为:Fe2O3;
(2)G为硫酸亚铁,加入碱生成白色的氢氧化亚铁,氢氧化亚铁不稳定,易与氧气反应生成红褐色的氢氧化铁沉淀,有关反应方程式为:FeSO4+NaOH=Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色;FeSO4+NaOH=Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)A转化为B的化学方程式:2Fe+3Cl2=2FeCl3,
故答案为:2Fe+3Cl2=2FeCl3;
(4)B→F的离子方程式为:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+,检验该反应生成的金属阳离子操作方法及现象:取反应后溶液少量滴入酸性高锰酸钾,若紫红色褪去,或滴入铁氰化钾生成蓝色沉淀即证明生成Fe2+离子,
故答案为:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+;取反应后溶液少量滴入酸性高锰酸钾,若紫红色褪去,或滴入铁氰化钾生成蓝色沉淀即证明生成Fe2+离子.
点评 本题考查无机物推断,物质的颜色及反应现象是推断突破口,难度中等,注意掌握亚铁离子、铁离子检验方法.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L苯中含有的碳碳双键数目为1.5NA | |
| B. | 常温常压下,2.8g由N2和CO组成的混合气体中含有的原子数为0.1NA | |
| C. | 25℃时,1.0LpH=12的Na2CO3溶液中含有的阴离子数大于0.01NA | |
| D. | 在反应:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2中,生成1molCu,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60,.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60,.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.| 滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
| 第一次 | 0.30 | 31.12 |
| 第二次 | 0.36 | 31.56 |
| 第三次 | 1.10 | 31.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知如表为25℃时某些弱酸的电离平衡常数;如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.
已知如表为25℃时某些弱酸的电离平衡常数;如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.| CH2COOH | HClO | H2CO2 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
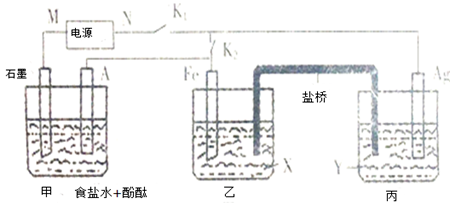
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
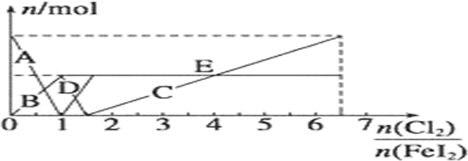
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  如果MnO2过量,浓盐酸就可全部消耗 | |
| B. |  量筒中发生了取代反应 | |
| C. |  生成蓝色的烟 | |
| D. |  干燥的有色布条褪色,说明氯气有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3易液化,液氨常用作制冷剂 | |
| B. | 与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3 | |
| C. | 浓H2SO4不稳定,光照易分解 | |
| D. | CO2、NO2或SO2都会导致酸雨的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将洁净的金属片A、B、C、D 分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如表所示:
将洁净的金属片A、B、C、D 分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如表所示:| 金属 | 电子流动方向 | 电压/V |
| A | A→Fe | +0.76 |
| B | Fe→b | -0.18 |
| C | C→Fe | +1.32 |
| D | D→Fe | +0.28 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com