
足量的锌加入100mL的盐酸溶液中反应,生成标准状况下的H24.48L。回答:
(1)盐酸溶液的物质的量浓度。
(2)取该盐酸溶液10mL,加水稀释至100mL,求稀释后所得溶液的物质的量浓度。
解:设盐酸中溶质的物质的量为x
Zn + 2HCl=ZnCl2+H2↑
2 1
x 0.2mol
x=0.2×2=0.4mol
C=n/V=0.4mol/0.1L= 4mol/L 在溶液稀释前后,溶质的物质的量不变,可得C1V1=C2V2稀释后盐酸的物质的量浓度:C2=(C1V1)/V1=(4mol/L×10ml)÷100ml=0.4mol/L.
解析试题分析:由锌与盐酸反应的方程式为:Zn + 2HCl=ZnCl2+H2↑ 可知盐酸与放出的氢气物质的量关系是1:2。n(H2)=4.48L/22.4(mol/L)=0.2mol.所以n(HCl)=0.4mol.C(HCl)=n(HCl)/V=0.4mol./0.1L=4mol/L.在溶液稀释前后溶质的物质的量不变,利用稀释公式:C1V1=C2V2可得稀释后的浓度为:C2=(C1V1)/V1=(4mol/L×10ml)÷100ml=0.4mol/L.
考点:考查阿伏伽德罗定律、物质的量浓度、溶液的稀释等计算的知识。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:填空题
某草酸盐晶体KxFey(C2O4)z?wH2O中铁为+3价,草酸根为-2价,且知x+y+z=7。取该晶体做了以下实验:
① 取4.910g晶体在不同温度下加热至恒重,所得固体的化学式和质量如下表:
| | 120℃ | 300℃ | 480℃ |
| 化学式 | KxFey(C2O4)z | KxFeyO(C2O4)z-1 | KxFeyO2(C2O4)z-2 |
| 质量 | 4.370g | 3.650g | 2.930 g |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
硫化钠是由无水硫酸钠与炭粉在高温下反应制得。反应的化学方程式如下:
① Na2SO4+ 4C→ Na2S+ 4CO↑ ② Na2SO4+ 4CO→ Na2S+ 4CO2↑
(1)要制取Na2S 15.6 g,需原料芒硝(Na2SO4·10H2O)_____________mol。
(2)制得的Na2S固体中含少量Na2SO4、碳粉等杂质。称取该固体0.200 g,加适量水溶解后加入25.0 mL 0.100 mol/L的I2标准液,待反应完全后用0.100 mol/L Na2S2O3溶液滴定,消耗Na2S2O3溶液16.0 mL(已知:滴定时 Na2S2O3转化为Na2S4O6),则该Na2S的纯度为__________。
(3)① 若在反应过程中,产生CO和CO2混合气体的体积为44.8L(标准状况),生成Na2S的物质的量(n mol)的范围是__________< n < ___________;
② 若在上述过程中生成Na2S的质量为62.4 g,则混合气体中CO和CO2的体积比是多少?
(4)硫化钠晶体(Na2S·9H2O)放置在空气中,会缓慢氧化成Na2SO3·7H2O和Na2SO4·10H2O。现称取在空气中已部分氧化的硫化钠晶体25.76 g溶于水,加入足量用盐酸酸化的BaCl2溶液,过滤得沉淀5.62 g,放出H2S气体1.12 L(标准状况),求原硫化钠晶体的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
已知反应:SO2+Cl2+2H2O=2HCl+H2SO4,若反应过程中消耗SO2标准状况下2.24L,
则:(1)求转移电子的数目。
(2)反应后溶液中H+的物质的量为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
向100 mL水中投入K和Al共15 g,充分反应后,剩余金属为1.8 g
(1)计算放出H2多少升(标准状况下)
(2)过滤出未反应的金属,向滤液中逐滴加入4 mol/L 的 H2SO4 溶液,生成沉淀的最大值是多少,此时消耗 H2SO4 溶液的体积是多少?
(3)生成沉淀后,再加入H2SO4 溶液,使沉淀刚好完全溶解,此时消耗 H2SO4 溶液的体积是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将5.0g碳酸钙放入一定量稀盐酸中恰好完全反应,得到40mL密度为1.32g/mL的溶液。试计算:
(1)生成标准状况下的二氧化碳气体多少升?(不考虑CO2在水中的溶解)
(2)所得溶液中氯化钙的物质的量浓度。
(3)所用稀盐酸的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
现欲配制100 mL 1.0 mol/L的硫酸铜(CuSO4)溶液,试求:
(1)若用无水硫酸铜配制,则需要无水硫酸铜粉末的质量是多少?
(2)若用5.0 mol/L CuSO4溶液配制,则需要该溶液多少毫升?
(3)若用胆矾(CuSO4 5H2O)配制,则需要胆矾的质量是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物。甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量。
甲组同学取了数分相同质量的样品A溶于水,然后分别加入不同体积的1mol/L的NaOH溶液,水浴加热至气体全部逸出。(此温度下,铵盐不分解)。该气体干燥后用足量的浓硫酸完全吸收。浓硫酸增重的质量与加入NaOH溶液的体积的关系如图。分析该图像,并回答下列问题: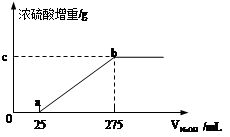
(1)写出ab段涉及的离子方程式: 。
(2)c点对应的数值是 ;样品A中(NH4)2SO4、NH4HSO4的物质的量之比为 。乙组同学取了数份不同质量的样品B,分别加入到200mL 1mol/L的NaOH溶液中,同样用水浴加热,将逸出气体干燥后再用浓H2SO4吸收。测定结果如下表:
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 铵盐的质量(g) | 9.88 | 19.76 | 29.64 | 49.40 |
| 浓硫酸增加的质量(g) | m | m | 1.36 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
用氯化钠固体配制1.00mol/L的NaCl溶液95mL,回答下列问题
⑴所需仪器为:托盘天平、量筒、烧杯胶头滴管,若要完成实验,还需要两种玻璃仪器为 、 。
⑵该实验的实验步骤为:
①计算,②称量 gNaCl, ③溶解,④移液,⑤洗涤,⑥定容,⑦ 摇匀。
⑶试分析下列操作,对所配溶液的浓度有何影响。(用偏低、偏高、无影响填空)。
①用天平称量氯化钠后,发现砝码底部有锈斑。所配溶液的浓度 ;
②为加速固体溶解,微热烧杯溶液并不断搅拌。在未降至20℃时,就将溶液转移至容量瓶定容。所配溶液的浓度 ;
③容量瓶不干燥,含有少量蒸馏水。所配溶液的浓度 ;
④若定容时仰视刻度线。所配溶液的浓度 ;
⑤定容后,加盖、倒转、摇匀后,发现液面低于刻度线,又补加蒸馏水至刻度。则所配溶液的浓度 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com