
【题目】氢氧化铁胶体制备步骤如下:
①用烧杯取少量蒸馏水,放在酒精灯上加热至沸腾;
②向烧杯中逐滴加入饱和FeCl3溶液;
③继续煮沸至液体是透明的红褐色,即得Fe(OH)3胶体.
回答下列问题:
(1)写出制备Fe(OH)3胶体的化学方程式;
(2)如何确定你制备胶体是否成功?;
(3)若向Fe(OH)3胶体中逐滴加入H2SO4溶液至过量会出现的现象: .
【答案】
(1)FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
(2)出现丁达尔效应说明胶体制备成功
(3)先出现红褐色沉淀,随后沉淀溶解
【解析】解:(1)制备Fe(OH)3胶体是利用了Fe3+在溶液中结合了水中的OH﹣,生成了Fe(OH)3(胶体)和HCl,化学方程式为:FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl,
Fe(OH)3(胶体)+3HCl,
故答案为:FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl;
Fe(OH)3(胶体)+3HCl;
(2)胶体区别于其他分散系的特有的性质为丁达尔效应,故要判断胶体是否制备成功,可以用丁达尔效应来判断,当可见光通过时出现一条光亮的通路,
故答案为:出现丁达尔效应说明胶体制备成功;
(3)向Fe(OH)3胶体中逐滴加入H2SO4溶液至过量,电解质H2SO4电离出的SO42﹣使Fe(OH)3胶体发生聚沉,生成红褐色沉淀,氢氧化铁胶体聚沉后会产生氢氧化铁沉淀,继续加入硫酸,会发生酸碱中和反应,生成氯化铁和水,此反应的离子方程式是Fe(OH)3+3H+═Fe3++3H2O,出现的现象为:先出现红褐色沉淀,随后沉淀溶解,
故答案为:先出现红褐色沉淀,随后沉淀溶解.
(1)利用饱和氯化铁溶液在沸水中水解制备Fe(OH)3胶体;
(2)丁达尔效应是胶体的独有的性质;
(3)根据胶体的性质判断,加入稀硫酸产生聚沉现象;氢氧化铁胶体聚沉后会产生氢氧化铁沉淀,硫酸和氢氧化铁沉淀反应,生成硫酸铁和水


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.硫酸的摩尔质量是98 g
B.氯原子的摩尔质量等于氯的相对原子质量
C.标准状况下,任何物质的摩尔体积都约是22.4 L
D.1 mol氧气的质量为32 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A是农药生产中的一种中间体,其结构简式如下  ,下列叙述正确的是( )
,下列叙述正确的是( )
A.有机物A属于芳香烃
B.有机物A和浓硫酸混合加热,可以发生消去反应
C.有机物A中含有两种官能团
D.l mol A和足量的NaOH溶液反应,最多可以消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( ) 
A.氯化钠固体不导电,所以氯化钠是非电解质
B.向纯水中加入碳酸钠能使水的电离平衡正向移动,水的离子积增大
C.如右图研究的是铁的吸氧腐蚀,实验中红色首先在食盐水滴的中心出现
D.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s) 的△H<0△S<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于合金的叙述,不正确的是
A. 合金的熔沸点一般比组成它们的各成分金属要高
B. 合金的硬度可以比原金属更高,化学性质也可能和原成分金属不同
C. 非金属和金属之间也可以形成合金
D. 合金的用途比纯金属的用途更广。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在下列指定条件的各溶液中,一定能大量共存的离子组是( )
A.含0.1 molL﹣1SO2的溶液中:Na+、Ba2+、Br﹣、Cl﹣
B.能与金属铝反应放出氢气的溶液中:K+、Mg2+、NO ![]() 、SiO
、SiO ![]()
C.![]() ?=10﹣12的溶液中:K+、NH
?=10﹣12的溶液中:K+、NH ![]() 、SO
、SO ![]() 、NO
、NO ![]()
D.不能使酚酞变红的无色溶液中:Na+、K+、ClO﹣、I﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,Ksp(AgCl)=1.8×10﹣10 , Ksp(Ag2S)=6.3×10﹣50 . 下列说法正确的是( )
A.25℃时,AgCl的溶解度小于Ag2S的溶解度
B.在25℃的AgNO3溶液中,AgCl的溶解度、Ksp均减小
C.25℃时,在AgCl悬浊液中加入0.1molL﹣1 Na2S溶液,搅拌,生成Ag2S沉淀
D.若取0.144g的AgCl放入100mL水中(忽略溶液体积的变化),则溶液中c(Cl﹣)=1.0×10﹣2 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程. 【实验】在0.1molL﹣l MgSO4 , 0.05molL﹣l﹣Al2( SO4)3的混合溶液中滴加0.5mol.L﹣1NaOH溶液,借助氢离子传感器和相应分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示.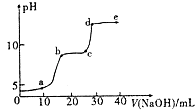
(1)为精确控制加入NaOH溶液的体积,可将NaOH溶液置于(填仪器名称)中滴加.
(2)图中有三个pH增加缓慢的阶段,第一阶段(a点前)对应的实验现象是 .
(3)对第二阶段(b、c之间)溶液pH变化缓慢的本质,小组同学做出如下推测,请补充推测2和3: 推测l:生成Mg( OH)2沉淀,消耗OH ﹣;
推测2:;
推测3.
若推测l符合实际情况,则a点之前反应的离子方程式为一,请据此描述Mg( OH)2 , A1( OH)3两种物质在水溶液中溶解性的差异.
(4)请分析e点后溶液中较大量存在的含金属元素的离子并设计实验检验(可不填满):
较大量存在的含金属元素的离子 | 检验方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com