
| A. | 分子中键能越大,键长越长,则分子越稳定 | |
| B. | 乳酸分子[CH3-CH(OH)-COOH]中有 1 个手性碳且 1 mol 该分子中有 11 mol σ 键 | |
| C. | PCl5分子中P原子和Cl原子最外层都满足8电子结构 | |
| D. | H-O键键能为463 kJ/mol,即18 g H2O分解成H2和O2时,消耗能量为2×463 kJ |
分析 A.键长越短,键能越大,分子越稳定;
B.碳原子连接四个不同的原子或原子团时,该碳原子为手性碳原子,单键中含有一个 σ 键,双键中含有一个 σ 键和一个π键;
C.共价化合物分子中元素原子最外层电子数+|该元素化合价|(或共价键数目)=8,该元素原子满足8电子结构;
D.水分解生成氧气和氢气时,焓变=断键吸收的能量-成键放出的能量.
解答 解:A.键长越短,键能越大,分子越稳定,键长越长,键能越小,分子越不稳定,故A错误;
B.乳酸分子[CH3-CH(OH)-COOH]中第二个碳原子属于 个手性碳,分子中含有10个单键和1个双键,所以 1 mol 该分子中有 11 mol σ 键,故B正确;
C.PCl5分子中P原子最外层电子数为5+5=10,不满足8电子结构,故C错误;
D.水分解生成氧气和氢气时,焓变=断键吸收的能量-成键放出的能量,氧气和氢气的键能未知,所以无法计算反应热,则18 g H2O分解成H2和O2时,消耗能量无法计算,故D错误.
故选B.
点评 本题考查较综合,涉及键能、手性分子、8电子结构、反应热知识点,熟练掌握基本概念、基本理论即可解答,题目难度不大,侧重于考查学生的分析能力和计算能力.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:解答题
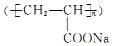 和苯甲酸异丙酯流程如下(部分条件已经略去):
和苯甲酸异丙酯流程如下(部分条件已经略去):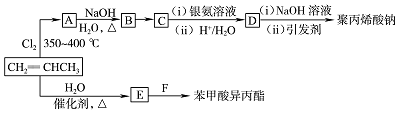
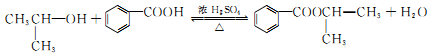 .
.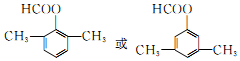 .
.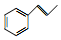 和F为原料(无机试剂任选),设计制备有机物
和F为原料(无机试剂任选),设计制备有机物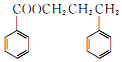 的合成路线.
的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液中:Na+、K+、Br-、CO32- | |
| B. | 0.1 mol/LCa(ClO)2溶液中:Fe2+、A13+、I-、SO42- | |
| C. | 0.1 mol/L Fe2(SO4)3溶液中:NH4+、Cu2+、NO3-、SO42- | |
| D. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13 mol/L的溶液中:Ca2+、NH4+、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
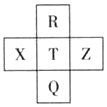 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | T的单质在化学反应中只表现氧化性 | |
| B. | R与Q的电子数相差16 | |
| C. | T形成的含氧酸的酸性一定比X形成的含氧酸强 | |
| D. | 在这五种元素中Z的化学性质最稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 75.77%表示35Cl的质量分数 | |
| B. | 24.23%表示35Cl在自然界所占的原子个数百分比 | |
| C. | 35.453表示氯元素的相对原子质量 | |
| D. | 36.966表示37Cl的质量数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
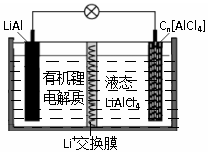 某种新型电池的工作原理如图”所示.Cn为石墨烯,液态LiAlCl4中含有Li+和AlCl4-.下列说法正确的是( )
某种新型电池的工作原理如图”所示.Cn为石墨烯,液态LiAlCl4中含有Li+和AlCl4-.下列说法正确的是( )| A. | 充电时,Cn为阳极,电极反应为:Cn+AlCl4--e-═Cn[AlCl4] | |
| B. | 放电时,当电路中通过0.1mol电子时,有0.1molLi+通过交换膜向LiAl极移动 | |
| C. | LiAl具有强氧化性,放电时作负极材料 | |
| D. | 电池中可能发生副反应:2Al+6H2O═2Al(OH)3+3H2↑,故该电池存在安全隐患 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z的简单气态氢化物的热稳定性比Y的强 | |
| B. | 原子半径:r(W)>r(Q)>r(Z)>r(X) | |
| C. | 由X、Y、Z三种元素组成的化合物可以是酸、碱或盐 | |
| D. | Q的最高于氧化物对应的水化物可以溶于浓的YX4W溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
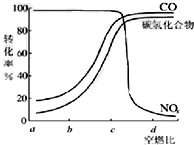 在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(Y)<r(Z) | |
| B. | X与Y只能形成一种化合物 | |
| C. | W的最高价氧化物对应的水化物的酸性比R的强 | |
| D. | Z的简单气态氢化物的热稳定性比R的强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com