
【题目】某无色溶液中含有H+、Al3+、Mg2+三种阳离子,逐滴加入0.1moLL﹣1NaOH溶液,消耗NaOH溶液体积(X轴)和生成沉淀(Y轴)之间的函数关系如图所示,则溶液中H+、Al3+、Mg2+三种阳离子的物质的量浓度之比为( )
A.1:1:1
B.2:2:1
C.2:1:1
D.1:1:2
【答案】B
【解析】假定NaOH溶液的浓度为cmol/L,则:
根据图象知,横坐标为0﹣10mL时发生的反应是:H++OH﹣=H2O,加入10mLNaOH溶液结合中和氢离子,n(H+)=n(NaOH)=0.01L×cmol/L=0.01cmol;
横坐标为50﹣60mL时,发生的化学反应是:Al(OH)3+OH﹣=AlO2﹣+2H2O,Al(OH)3完全溶解消耗消耗10mLNaOH溶液,由方程式可知n[Al(OH)3]=n(NaOH)=0.01L×cmol/L=0.01c,再根据铝元素守恒可知,n(Al3+)=n[Al(OH)3]=0.01cmol;
横坐标为10﹣50mL时发生的化学反应是:Mg2++2OH﹣=Mg(OH)2↓、Al3++3OH﹣=Al(OH)3↓,沉淀为最大值时,该阶段消耗40mLNaOH溶液,根据OH﹣守恒,2n[Mg(OH)2]+3n[Al(OH)3]=n(NaOH),故2n[Mg(OH)2]+0.03c=0.04L×cmol/L,故n[Mg(OH)2]=0.005cmol,则溶液中H+、Al3+、Mg2+三种阳离子的物质的量浓度之比为0.01c:0.01c:0.005c=2:2:1,
故答案为:B.
开始没有沉淀生成发生了断键中和反应,据此计算氢离子的物质的量;沉淀量达到最大值后溶解是因为氢氧化铝与氢氧化钠的反应,据此计算吕磊床额物质的量;最后根据沉淀的最大值计算镁离子的物质的量即可.


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】工业制硫酸中的一步重要反应是SO2在400~500℃下的催化氧化:2SO2+O2![]() 2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
A. 在上述条件下,SO2不可能100%地转化为SO3
B. 使用催化制是为了加快反应速率,提高生产效率
C. 为了提高SO2的转化率,应适当提高O2的浓度
D. 达到平衡时,SO2的浓度与SO3的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质分别注入水中,振荡后静置,能分层浮于水面的是( )
①苯 ②乙酸乙酯 ③乙醇 ④乙酸 ⑤油脂 ⑥四氯化碳
A. ①②③ B. ①③⑤ C. ①②⑤ D. ①②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物中,实验式相同,且既不是同系物,又不是同分异构体的是( )
A. 1-辛烯和3-甲基-1-丁烯 B. 苯和乙炔
C. 1-氯丙烷和2-氯丙烷 D. 甲苯和乙苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,用0.0200mol/L稀盐酸滴定20.00mL0.0200mol/LNaY溶液,溶液中水的电离程度随所加稀盐酸的体积变化如图所示(忽略滴定过程中溶液的体积变化),则下列有关说法正确的是
已知:K(HY)=5.0×10-11

A. 可选取酚酞作为滴定指示剂 B. M点溶液的pH>7
C. 图中Q点水的电离程度最小,Kw<10-14 D. M点,c(Na+)=c(HY)+c(Y-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如图所示.下列说法中正确的是( )
A.30min时降低温度,40min时充入生成物C
B.0~8min内A的平均反应速率为0.08mol/(Lmin)
C.反应方程式中的x=1,正反应为吸热反应
D.20min~40min间该反应的平衡常数均为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、O、Al、Si、Cu是常见的六种元素.
(1)Si位于元索周期表第周期第族.
(2)N原子的原子结构示意图为;Cu的低价氧化物的颜色为 .
(3)用“>”或“<”填空:
原子半径 | 电负性 | 熔点 | 沸点 |
AlSi | NO | 金刚石晶体硅 | CH4SiH4 |
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生.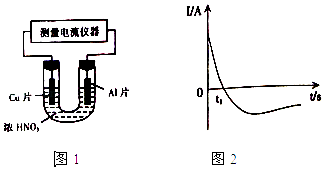
0﹣t1时,原电池的负极是Al片,此时,正极的电极反应式是 , 溶液中的H+向极移动,t1时,原电池中电子流动方向发生改变,其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于1.5mol NH3的说法错误的是( )
A.摩尔质量为17 gmol﹣1
B.所含的分子数目约为9.03×1023
C.在标准状况下体积约为33.6L
D.溶于水制成0.5L溶液时物质的量浓度为1.5molL﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com