
��˹������Ϊ���������غ��,���ܻ�ѧ��Ӧ������һ����ɻ�ּ������,�������̵���ЧӦ����ͬ�ġ�
��֪:��H2O(g)=H2O(l) ��H1=-Q1 kJ/mol
��C2H5OH(g)=C2H5OH(l) ��H2=-Q2 kJ/mol
��C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)��H3=-Q3 kJ/mol
��ʹ23 gҺ̬��ˮ�ƾ���ȫȼ��,���ָ�������,��ų�������Ϊ(��λ:kJ)�� ��
| A��Q1+Q2+Q3 | B��1.5Q1-0.5Q2+0.5Q3 |
| C��0.5Q1-1.5Q2+0.5Q3 | D��0.5(Q1+Q2+Q3) |
 ��Ԫȫ��������ϵ�д�
��Ԫȫ��������ϵ�д� �»ƸԱ����ܾ�ϵ�д�
�»ƸԱ����ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪�� Cu ��s��+2H+��aq����Cu2+��aq��+ H2��g�� ��H 1
2H2O2��l����2H2O��l�� + O2 ��g�� ��H 2
2H2��g�� + O2��g����2H2O��l�� ��H 3
��Ӧ Cu ��s��+H2O2��l��+2H+ ��aq����Cu2+��aq��+ 2H2O��l�� �ġ�H��
A����H����H 1+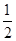 ��H 2+ ��H 2+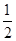 ��H 3 ��H 3 | B����H����H 1+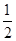 ��H 2- ��H 2-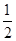 ��H 3 ��H 3 |
| C����H����H 1+2��H 2+2��H 3 | D����H��2��H 1+��H 2+��H 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪2 mol������ȫȼ������ˮ����ʱ�ų�����484 kJ����������1 mol O===O����ȫ����ʱ��������496 kJ��ˮ������1 mol H��O���γ�ʱ�ų�����463 kJ����������1 mol H��H������ʱ��������Ϊ(����)��
| A��920 kJ | B��557 kJ | C��436 kJ | D��188 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���и����Ȼ�ѧ����ʽ�У�Q1��Q2���ǣ� ��
| A��CH4(g)��2O2(g)=CO2(g)��2H2O(g)����H����Q1 kJ��mol��1 CH4(g)��3/2O2(g)=CO(g)��2H2O(g)����H����Q2 kJ��mol��1 |
| B��S(g)��O2(g)=SO2(g)����H����Q1 kJ��mol��1 S(s)��O2(g)=SO2(g)����H����Q2 kJ��mol��1 |
| C��H2(g)��Br2(g)=2HBr(g)����H����Q1 kJ��mol��1 H2(g)��Cl2(g)=2HCl(g)����H����Q2 kJ��mol��1 |
| D��HCl(aq)��NaOH(aq)=NaCl(aq)��H2O(l)����H����Q1 kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ʢ��NH4HCO3��ĩ��С�ձ�����ʢ����������Ĵ��ձ��С�Ȼ����С�ձ��м������ᣬ��Ӧ���ң����������̡��ɴ˿ɼ��� ��
| A��NH4HCO3������ķ�Ӧ�Ƿ��ȷ�Ӧ |
| B���÷�Ӧ�У�����ת��Ϊ�����ڲ������� |
| C����Ӧ�������������������������� |
| D����Ӧ���Ȼ�ѧ����ʽΪ��NH4HCO3��HCl=NH4Cl��CO2����H2O����H����Q |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
ij��Ӧ�Ħ�H��+100 kJ��mol��1�������йظ÷�Ӧ��������ȷ����( )
| A������Ӧ���С��100 kJ��mol��1 |
| B���淴Ӧ���һ��С��100 kJ��mol��1 |
| C������Ӧ��ܲ�С��100 kJ��mol��1 |
| D������Ӧ��ܱ��淴Ӧ��ܴ�100 kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ����
��CH3OH��g����H2O��g��=CO2��g����3H2��g��
��H1����49.0 kJ/mol��
��CH3OH��g����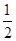 O2��g��=CO2��g����2H2��g��
O2��g��=CO2��g����2H2��g��
��H2����192.9 kJ/mol��
����������Ӧ������˵����ȷ���ǣ�������
| A����Ӧ���е������仯����ͼ��ʾ |
| B��CH3OHת���H2�Ĺ���һ��Ҫ�������� |
| C��1 mol CH3OH���ȼ�շų�������Ϊ192.9 kJ |
| D������֪2H2��g����O2��g��=2H2O��g�� ��H����483.8 kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪Zn��s����H2SO4��aq��=ZnSO4��aq����H2��g������H<0����������������ȷ���ǣ�������
| A���÷�Ӧ�Ħ�Hֵ�뷴Ӧ�������� |
| B���÷�Ӧ�Ļ�ѧ�ܿ���ת��Ϊ���� |
| C����Ӧ�������������������������� |
| D���÷�Ӧ�з�Ӧ��Ļ�ѧ�����ѷų������������ﻯѧ���γ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
100 g̿��ȼ�����������У�COռ ��CO2ռ
��CO2ռ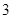 ����C(s)��
����C(s)��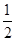 O2(g)=CO(g)����H����110.35 kJ��mol��1��CO(g)��
O2(g)=CO(g)����H����110.35 kJ��mol��1��CO(g)��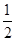 O2(g)=CO2(g)����H����282.57 kJ��mol��1������Щ̿����ȫȼ�������ʧ�������� (����)��
O2(g)=CO2(g)����H����282.57 kJ��mol��1������Щ̿����ȫȼ�������ʧ�������� (����)��
| A��784.92 kJ | B��2 489.44 kJ | C��1 569.83 kJ | D��3 274.3 kJ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com