
【题目】偏钒酸铵(NH4VO3)主要用作催化剂、催干剂、媒染剂等。用沉淀法除去工业级偏钒酸铵中的杂质硅、磷的流程如下:
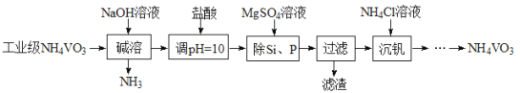
(1)碱溶时,下列措施有利于NH3逸出的是_____(填字母)。
A.升高温度 B.增大压吸 C.增大NaOH溶液的浓度
(2)①滤渣的主要成分为Mg3(PO4)2、MgSiO3,已知Ksp(MgSiO3)=2.4×l0-5.若滤液中c(SiO32-)=0.08mol/L,则c(Mg2+)=__________。
②由图可知,加入一定量的MgSO4溶液作沉淀剂时,随着温度的升高,除磷率下降,其原因是温度升高,Mg3(PO4)2溶解度增大和_______;但随着温度的升高,除硅率升高,其原因是______(用离子方程式表示)。

(3)沉钒时,反应温度需控制在50℃,在实验室可采取的加热方式为_______。
(4)探究NH4Cl的浓度对沉钒率的影响,设计实验步骤(常见试剂任选):取两份10mL一定浓度的滤液A和B,分别加入lmL和10mL的1mol/LNH4Cl溶液,再向A中加入_______mL蒸馏水,控制两份溶液温度均为50℃、pH均为8,由专用仪器洲定沉钒率。加入蒸馏水的目的是______。
(5)偏钒酸铵本身在水中的溶解度不大,但在草酸(H2C2O4)溶液中因发生氧化还原反应而溶解,同时生成络合物(NH4)2[(VO)2(C2O4)3],该反应的化学方程式为_________。
【答案】⑴ ac
⑵① 3×10-4mol·L-1 ②促进Mg2+水解生成Mg(OH)2
SiO32-+2H2O![]() H2SiO3↓+2OH-(或SiO32-+3H2O
H2SiO3↓+2OH-(或SiO32-+3H2O![]() H4SiO4↓+2OH-)
H4SiO4↓+2OH-)
⑶水浴加热
⑷9 使两份溶液总体积相等,便于比较
⑸2NH4VO3+4H2C2O4═(NH4)2[(VO)2(C2O4)3]+2CO2↑+4H2O
【解析】以沉淀法除去工业级偏钒酸铵(NH4VO3)中硅、磷元素杂质的流程为:在偏钒酸铵中加氢氧化钠溶液,将偏钒酸铵溶解,铵盐遇到强碱生成氨气,再加盐酸调节溶液的pH值,加硫酸镁,生成Mg3(PO4)2、MgSiO3沉淀,过滤除去滤渣,在滤液中加氯化铵得偏钒酸铵。
(1)根据气体在水中溶解度的影响因素可知,升温、减压都可以减小气体的溶解度,故选a,由于氨气在水中形成氨水能电离出氢氧根离子,根平衡移动原理,增加氢氧根浓度可以减小氨气 的溶解度,故选c,故答案为:ac;
(2)①根据Ksp[Mg3(PO4)2]=c3(Mg2+)c2(PO43-)可知,当c(PO43-)=10-6 molL-1时,c(Mg2+)=![]() =4×10-5molL-1,故答案为:4×10-5;
=4×10-5molL-1,故答案为:4×10-5;
②根据影响盐类水解的因素可知,升高温度水解程度增大,镁离子、硅酸根离子都是易水解的离子,所以升温促进Mg2+水解生成Mg(OH)2,使硅酸根水解生成硅沉淀,反应的离子方程式为SiO32-+2H2O![]() H2SiO3↓+2OH-(或者SiO32-+3H2O
H2SiO3↓+2OH-(或者SiO32-+3H2O![]() H4SiO4↓+2OH-),故答案为:SiO32-+2H2O
H4SiO4↓+2OH-),故答案为:SiO32-+2H2O![]() H2SiO3↓+2OH-(或者SiO32-+3H2O
H2SiO3↓+2OH-(或者SiO32-+3H2O![]() H4SiO4↓+2OH-);
H4SiO4↓+2OH-);
(3)反应温度需控制在50℃可以用水浴加热,故答案为:水浴加热;
(4)探究NH4Cl的浓度对沉钒率的影响,为要有可比性,两溶液的体积必须相等,所以要 向A中加入约9 mL蒸馏水,使两份溶液总体积相等,故答案为: 9;使两份溶液总体积相等,便于比较;
(5)偏钒酸本身在水中的溶解度不大,但在草酸(H2C2O4)溶液中因发生氧化还原反应而溶解,同时生成络合物(NH4)2〔(VO)2(C2O4)3〕,反应的化学方程式为2NH4VO3+4H2C2O4═(NH4)2[(VO)2(C2O4)3]+2CO2↑+4H2O,故答案为:2NH4VO3+4H2C2O4═(NH4)2[(VO)2(C2O4)3]+2CO2↑+4H2O。


科目:高中化学 来源: 题型:
【题目】工业上利用软锰矿(主要成分为MnO2)用来制备“锰白”(MnCO3)和电极材料锰酸锂(LiO2·2MnO2·Mn2O3),期其工艺流程如下:

(1)“浸出”过程中SO2作用是__________。
(2)为使原料充分利用,滤液中c(Mn2+)应当小于__________mol·L-1。已知:常温下MnCO3的Kap=9.0×10-12。
(3)写出软锰矿与Li2CO3发生“高温还原”的化学方程式:____________。
(4)锰酸锂((LiO2·2MnO2·Mn2O3,M=362g· mol-1)中掺入LiMnO2能大幅提高电容量,实验室测定某电极材料中两者配比的操作步骤如下;准确称取2.012g的试样于锥形瓶中,加入5mL稀硫酸充分溶解;向上述所得溶液中加入10.00mL2.000mol·L-1草酸钠(Na2C2O4)标准溶液,搅拌至溶液清亮,并定容至250mL;从容量瓶中取出25.00mL溶液,用0.01mol·L-1KMnO4标准溶液滴定,消耗KMnO4标准溶液20.00mL。
通过计算两者物质的量之比_____(写出计算过程)。
已知实验中设计的相关氧化还原反应如下:
①Mn2++C2O42-→Mn2++2CO2↑②Mn4++C2O42-→Mn2++2CO2↑
③MnO4-+C2O42-+H+→Mn2++2CO2↑(均未配平)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】250°C,101Kpa时,2N2O5(g)=4NO2(g)+O2(g)△H=+56.76kJ/mol,该反应能自发进行,其自发进行的主要原因是( )
A.是吸热反应
B.是放热反应
C.是熵减反应
D.熵增效应大于能量效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124形式存在于溶液中。“废渣2”中含有_______。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124![]() R4V4O12+4OH(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”、“碱”或“中”)。
R4V4O12+4OH(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”、“碱”或“中”)。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是( )
A.SO2、SiO2、CO均为酸性氧化物
B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.盐酸、水玻璃、氨水均为混合物
D.烧碱、冰醋酸、四氯化碳均为电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式并注明反应类型、反应条件。
①乙醇在铜、加热的条件下与氧气反应的化学方程式:
_____________________________________、反应类型____________;
②乙烯和溴水反应化学方程式:
____________________________________、反应类型____________;
③苯和液溴反应化学方程式:
____________________________________、反应类型____________;
④实验室制取乙酸乙酯的化学方程式:
____________________________________、反应类型____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是熔点最高的金属,是重要的战略物资。自然界中钨主要存在于黑钨矿中,其主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、As的化合物。由黑钨矿冶炼钨的工艺流程如下:

已知:①滤渣I的主要成份是Fe2O3、MnO2。
②上述流程中,钨的化合价只有在最后一步发生改变。
③常温下钨酸难溶于水。
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为____,请写出MnWO4在熔融条件下发生碱分解反应生成Fe2O3的化学方程式__________。
(2)上述流程中向粗钨酸钠溶液中加硫酸中和至pH=10后,溶液中的杂质阴离子确SiO32-、HAsO32-、HAsO42-等,则“净化”过程中,加入H2O2时发生反应的离子方程式为____,滤渣Ⅱ的主要成分是____。
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。下图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则:

①T1 _____T2(填“>”或“<”)T1时Ksp(CaWO4)=____。
②将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com