
分析 实验有两个过程:为了配制准确浓度的草酸溶液,所需要的实验仪器主要有天平(含砝码)、烧杯、药匙、100mL容量瓶、胶头滴管、玻璃棒等;
用高锰酸钾溶液进行滴定测草酸的物质的量;
(1)草酸晶体滴入酸性高锰酸钾溶液发生氧化还原反应,2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O;
(2)配制溶液需要容量瓶,玻璃棒、烧杯滴定管;
(3)高锰酸钾具有强氧化性,会腐蚀橡胶管,应装在酸式滴定管中;
(4)由题给化学方程式及数据可得出X,若滴定用的KMnO4溶液因放置时间过长而部分变质,浓度偏低,则所得消耗酸性KMnO4溶液的体积偏大,由此所得n(H2C2O4)偏大,则n(H2O)偏小,x偏低;
(5)滴定终点时溶液颜色无色变化为紫色且在30s内颜色不再恢复为原来颜色,证明反应达到终点;
(6)滴定终点时俯视滴定管刻度,会导致测量体积偏小,测定草酸质量偏小,则x值会偏大.
(7)令草酸的浓度为cmol/L,根据反应方程式计算;
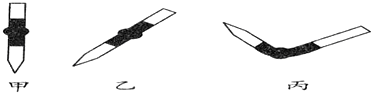
(8)根据碱式滴定管中排气泡的方法分析,把滴定管的胶头部分稍微向上弯曲,再排气泡;
解答 解:为了配制准确浓度的草酸溶液,所需要的实验仪器主要有天平(含砝码)、烧杯、药匙、100mL容量瓶、胶头滴管、玻璃棒等;
用高锰酸钾溶液进行滴定测草酸的物质的量,
(1)草酸晶体滴入酸性高锰酸钾溶液发生氧化还原反应,反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O;
故答案为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O;
(2)配制溶液需要容量瓶,玻璃棒、烧杯滴定管,定量玻璃仪器为100ml的容量瓶,
故答案为:100ml容量瓶;
(3)高锰酸钾具有强氧化性,会腐蚀橡胶管,应装在酸式滴定管中,
故答案为:酸式滴定管;
(4)若滴定用的KMnO4溶液因放置时间过长而部分变质,浓度偏低,由此所得n(H2C2O4)偏大,则n(H2O)偏小,x偏低,故答案为:偏低;
(5)滴定终点时,溶液颜色无色变化为紫色且在30s内颜色不再恢复为原来颜色,证明反应达到终点;
故答案为:无色变化为紫色;
(6)滴定终点时俯视滴定管刻度,会导致测量体积偏小,测定草酸质量偏小,则x值会偏大,
故答案为:偏大;
(7)2KMnO4 ~5H2C2O4
2mol 5mol
aV×10-3mol 0.025L×cmol/L
解得:c=0.1aVmol•L-1
故答案为:0.1aV;
(8)碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡,故选丙,
故答案为:丙.
点评 本题考查一定物质的量浓度溶液配制、滴定操作、滴定应用与计算、物质组成含量测定等,难度中等,注意滴定中经常根据关系式进行计算,掌握根据关系式计算方法.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9gD2O中含有的电子数为5NA | |
| B. | 4.5gSiO2晶体中含有的硅氧键的数目为0.15NA | |
| C. | 1molCH4分子中共价键总数为4NA | |
| D. | 7.1g C12与足量NaOH溶液反应转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱溶液显碱性的原因:CO32-+2H2O?H2CO3+2OH- | |
| B. | 氯化铁溶液腐蚀铜线路板Cu+Fe3+=Cu2++Fe2+ | |
| C. | 稀硫酸与氢氧化钡溶液恰好中和:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| D. | 氯气溶于水:Cl2+H2O=H++Cl-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由非金属元素形成的化合物都是共价化合物 | |
| B. | 酸、碱发生反应,只要生成1mol水放出的热量就相同 | |
| C. | 原电池工作时电流从正极流向负极 | |
| D. | 某物质溶于水得到的溶液可以导电,则该物质一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化亚铁中加入盐酸:S2-+2H+═H2S↑ | |
| B. | 向Ca(ClO)2溶液中通入SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 硫酸铝溶液和少量苏打溶液反应:3H2O+Al3++3CO32-═3HCO3-+Al(OH)3↓ | |
| D. | 钠和冷水反应:2Na+2H2O═2Na++H2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
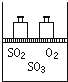 如图,将4mol SO2和2mol O2混合置于体积可变的等压密闭容器中,在一定温度下发生如下反应2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态时,测得气体的总物质的量为4.2mol.试回答:
如图,将4mol SO2和2mol O2混合置于体积可变的等压密闭容器中,在一定温度下发生如下反应2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态时,测得气体的总物质的量为4.2mol.试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com