
| A. | H2SO3 | B. | SO2 | C. | NaHSO3 | D. | Na2SO4 |
科目:高中化学 来源: 题型:选择题
| A. | 2.0mol/LKNO3溶液:H+、Fe2+、SCN-、SO42- | |
| B. | 2.0mol/LNaAlO2溶液:Cl-、HCO3-、K+、ClO- | |
| C. | 某澄清透明的溶液:Fe2+、SO42-、Mg2+、Cl- | |
| D. | c(ClO-)=2.0mol/L的溶液:Na+、I-、S2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是一种治疗心脏病的药物,可由甲基丙烯、丙烯和
)是一种治疗心脏病的药物,可由甲基丙烯、丙烯和 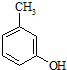 为原料制取.
为原料制取.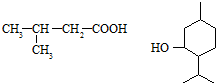 .
.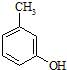 的名称3-甲基苯酚,其属于芳香族化合物的同分异构有4种(不含
的名称3-甲基苯酚,其属于芳香族化合物的同分异构有4种(不含 ).
). +CH3-CH=CH2$\stackrel{AlCl_{3}}{→}$
+CH3-CH=CH2$\stackrel{AlCl_{3}}{→}$ 反应类型属于加成反应.有机反应中通常副反应较多,实际生产中发现生成
反应类型属于加成反应.有机反应中通常副反应较多,实际生产中发现生成 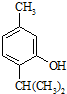 的量远大于生成
的量远大于生成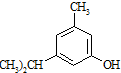 的量,试分析其原因:羟基使得苯环的邻对位氢原子易于取代.
的量,试分析其原因:羟基使得苯环的邻对位氢原子易于取代.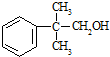 的合成线路:(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物 )
的合成线路:(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物 ) .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.85g | B. | 7.78g | C. | 6.72g | D. | 6g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ③④ | C. | ②④⑤ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐的电离平衡被破坏 | B. | 水的电离程度一定会增大 | ||
| C. | 溶液的pH一定会增大 | D. | c(H+)与c(OH-)的乘积一定会增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com