
| A. | 大理石的分解反应 | B. | 氢气燃烧 | ||
| C. | 氧化钙投入水中 | D. | 盐酸与氢氧化钠反应 |
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 强电解质 | HF | HClO4 | Ba(OH)2 | 食盐水溶液 |
| 弱电解质 | Cu(OH)2 | NH3•H2O | BaSO4 | HClO |
| 非电解质 | Cu | SO2 | 蔗糖 | H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应生成2mol氯化氢气体,吸收248KJ的能量 | |
| B. | 反应生成2mol氯化氢气体,放出183KJ的能量 | |
| C. | 反应物的总能量低于生成物的总能量 | |
| D. | 该反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入硫酸钠固体 | B. | 加入水 | ||
| C. | 加入100mL 1mol/L硫酸 | D. | 把锌粉换成锌粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
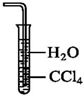
| A. | 氨气溶于水显碱性,所以氨气可以使湿润的酚酞试纸变蓝 | |
| B. | 氨气可以用浓硫酸干燥 | |
| C. | 用水吸收氨气可用如图的装置防止倒吸 | |
| D. | 氨气本身没有毒,因此氨气泄漏时,人们没有必要采取任何防范措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
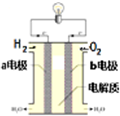 能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率.
能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
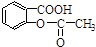 转变为
转变为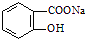 的方法为( )
的方法为( )| A. | 与稀H2SO4共热后,加入足量的Na2CO3 | |
| B. | 加入足量的NaOH溶液,再通入足量的HCl | |
| C. | 与足量NaOH的溶液共热后,再通入CO2 | |
| D. | 与稀H2SO4共热后,加入足量的NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com