
| A. | 1.0×10-7mol•L-1 | B. | 1.0×10-6mol•L-1 | ||
| C. | 1.0×10-2mol•L-1 | D. | 1.0×10-12mol•L-1 |
科目:高中化学 来源: 题型:选择题
| A. | 4.4g | B. | 3.3g | C. | 1.1g | D. | 2.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 题中氯的化合价变化为:0→-1,被还原,NaOH是还原剂 | |
| B. | 题中氯的化合价变化为:0→+1,被氧化,NaOH是氧化剂 | |
| C. | NaOH既是氧化剂,又是还原剂 | |
| D. | Cl2→Cl-的变化不一定是加还原剂才能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)=2H2O(g)△H=-Q1kJ/mol; 2H2(g)+O2(g)=2H2O(g))△H=-Q2kJ/mol | |
| B. | S(g)+O2(g)=SO2(g)△H=-Q1kJ/mol; S(s)+O2(g)=SO2(g))△H=-Q2kJ/mol | |
| C. | C(s)+$\frac{1}{2}$O2(g)=CO2(g))△H=-Q1kJ/mol; C(s)+O2(g)=CO(g))△H=-Q2kJ/mol | |
| D. | H2(g)+Cl2(g)=2HCl(g)△H=-Q1kJ/mol; $\frac{1}{2}$H2(g)+Cl2(g)=HCl(g))△H=-Q2kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol | B. | 3 mol | C. | 4 mol | D. | 5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氧元素的相对原子质量为$\frac{12a}{b}$ | B. | 1mol该原子质量为aNAg | ||
| C. | x g该氧原子所含的电子数为$\frac{8x}{a}$ | D. | y g 该氧原子的中子数一定为$\frac{8y}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高正价:X>Y>Z | B. | 酸性:H3ZO4>H2YO4>HXO4 | ||
| C. | 稳定性:HX>H2Y>H3Z | D. | 非金属性:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
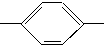 CH═N
CH═N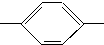 CH2CH2CH2CH3 MBBA
CH2CH2CH2CH3 MBBA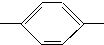 CHO 醛A
CHO 醛A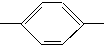 NH2 胺B
NH2 胺B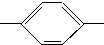 NH2、CH3CH2CH2CH2
NH2、CH3CH2CH2CH2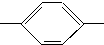 NH2、CH3CH2CH(CH3)
NH2、CH3CH2CH(CH3)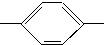 NH2、(CH3)3C
NH2、(CH3)3C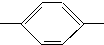 NH2.
NH2.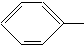 COOCH3、
COOCH3、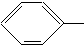 OOCCH3、HCOO
OOCCH3、HCOO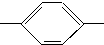 CH3、
CH3、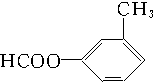 、
、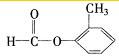 、
、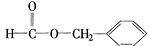 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
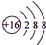 .
. .常温下,D2E2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中正确的是ACD.
.常温下,D2E2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中正确的是ACD.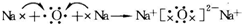 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com