
Na2S2O3·5H2O可作为高效脱氯剂,工业上用硫铁矿(FeS2)为原料制备该物质的流程如下。

已知:I.气体A可以使品红溶液褪色,与硫化氢(H2S)混合能获得单质硫。
II.pH约为11的条件下,单质硫与亚硫酸盐可以共热生成硫代硫酸盐。
回答下列问题:
(1)沸腾炉中将粉碎的硫铁矿用空气吹动使之达到“沸腾”状态,其目的是 。
(2)吸收塔中的原料B可以选用 (填字母序号)。
A.NaCl溶液 B.Na2CO3溶液 C.Na2SO4溶液
(3)某小组同学用下图装置模拟制备Na2S2O3 的过程(加热装置已略去)。
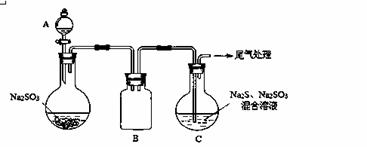
① A中使用70%的硫酸比用98%的浓硫酸反应速率快,其原因是 。装置B的作用是 。
② C中制备Na2S2O3发生的连续反应有:Na2S + H2O + SO2 ===Na2SO3 +H2S、
和Na2SO3 + S  Na2S2O3 。
Na2S2O3 。
(4)工程师设计了从硫铁矿获得单质硫的工艺,将粉碎的硫铁矿用过量的稀盐酸浸取,得到单质硫和硫化氢气体,该反应的化学方程式为 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
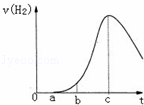
把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L﹣1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如图的坐标曲线来表示,下列推论错误的是( )
|
| A. | t由0→a段不产生氢气是因为表面的氧化物隔离了铝和硫酸溶液 |
|
| B. | t由b→c段产生氢气的速率增加较快的主要原因之一是温度升高 |
|
| C. | t>c产生氢气的速率降低主要是因为溶液中c(H+)降低 |
|
| D. | t=c时反应处平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
N2+3H2 2NH3是目前工业上合成氨的反应,下列关于该反应的说法正确的是( )
2NH3是目前工业上合成氨的反应,下列关于该反应的说法正确的是( )
|
| A. | 增加N2的浓度能加快反应速率 |
|
| B. | 降低体系温度能加快反应速率 |
|
| C. | 使用催化剂不影响反应速率 |
|
| D. | 若反应在密闭容器中进行,N2和H2能100%转化为NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,机动车废气排放已成为城市大气污染的重要来源.
(1)在汽车尾气系统中安装催化转换器,可有效减少尾气中的CO、NOx 和碳氢化合物等废气.
已知:N2(g)+O2(g)=2NO(g)△H1=+180kJ/mol
CO(g)+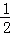 O2(g)=CO2(g)△H2=﹣283kJ/mol
O2(g)=CO2(g)△H2=﹣283kJ/mol
2NO(g)+2CO(g)=2CO2(g)+N2(g)△H3则△H3= kJ•mol﹣1.
(2)气缸中生成NO的反应为:N2(g)+O2(g)═2NO(g)△H>0
①汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因是 .
②1mol空气中含有0.8molN2和0.2molO2,1300℃时在含1mol空气的密闭容器内反应达到平衡,测得NO为8×10﹣4mol.计算该温度下的平衡常数K≈ .
(3)尾气中的CO主要来自于汽油不完全燃烧.
①有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)△H=+221kJ•mol﹣1,简述该设想能否实现的依据:
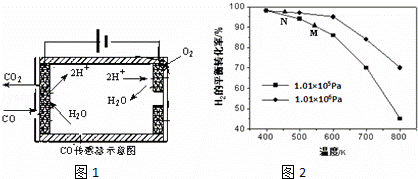
②测量汽车尾气的浓度常用电化学气敏传感器,其中CO传感器可用如图1简单表示,则阳极发生的电极反应为 .
(4)汽车尾气中的CO可转化为甲烷,方程式为CO(g)+3H2(g)⇌CH4(g)+H2O(g).其他条件相同时,H2的平衡转化率在不同压强下随温度的变化如图2所示.
①该反应的△H 0(填“<”、“=”或“>”).
②实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由 .
查看答案和解析>>
科目:高中化学 来源: 题型:
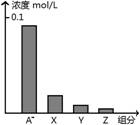
常温下,0.2 mol/L的一元酸.HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
A.HA为强酸
B.该混合液pH=7
C.图中X表示HA,Y表示OH-,Z表示H+
D.该混合溶液中:c(A-)+c(Y) =c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
在298 K时,实验测得溶液中的反应:H2O2+2HI====2H2O+I2,在不同浓度时的化学反应速率见下表,由此可推知当c(HI)=0.500 mol·L-1,c(H2O2)=0.400 mol·L-1时的反应速率为( )
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| c(HI)/mol·L-1·min-1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
| c(H2O2)/mol·L-1·min-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
| v/mol·L-1·s-1 | 0.007 60 | 0.015 3 | 0.022 7 | 0.015 1 | 0.022 8 |
A.0.038 0 mol·L-1·s-1 B.0.152 mol·L-1·s-1
C.0.608 mol·L-1·s-1 D.0.760 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组在实验室用三份不同初始浓度的氨基甲酸铵(NH2COONH4)溶液在不同温度下进行水解实验:NH2COONH4+2H2O NH4HCO3+
NH4HCO3+
NH3·H2O,测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法中正确的是 ( )
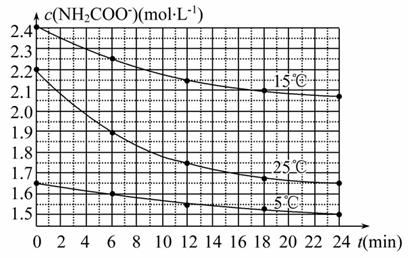
A.0~12 min,初始浓度越大的实验,水解反应速率越大
B.c(NH2COO-)将随反应时间的不断延长而不断减小
C.25 ℃时,0~6 min,v(NH2COO-)为0.05 mol·L-1·min-1
D.15 ℃时,第30 min时,c(NH2COO-)为2.0 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H—H键键能(断裂时吸收或生成时释放的能量)为436 kJ·mol-1,N—H键键能为391 kJ·mol-1,根据热化学方程式:N2(g)+3H2(g)===2NH3(g) ΔH=-92.4 kJ·mol-1。则N≡N键的键能是( )
A.431 kJ·mol-1 B.945.6 kJ·mol-1
C.649 kJ·mol-1 D.896 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com