
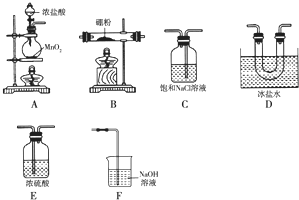
分析 (1)A中为浓盐酸和二氧化锰的反应,在加热条件下反应生成氯气;
(2)反应的原理为3Cl2+2B$\frac{\underline{\;\;△\;\;}}{\;}$2BCl3,实验室制备氯气,应先后分别饱和食盐水、浓硫酸得到纯净的氯气,然后与B在加热条件下反应生成BCl3,装置连接的顺序为气体发生装置---除杂装置--反应装置--收集装置--尾气处理装置的顺序,即:制备氯气(装置A)→净化氯气(装置C、F)→发生装置(B装置)→收集装置(装置D)→尾气处理装置(装置E),以此可确定连接顺序;BCl3易水解,所以实验前要先用氯气将装置中的空气排尽;
(3)装置E内装有碱石灰,可与氯气反应,防止污染空气,具有吸水作用,可防止空气中的水蒸气进入U形管;实验中若不用装置C,可发生2B+6HCl$\frac{\underline{\;\;△\;\;}}{\;}$2BCl3+3H2↑,氢气和氯气易发生爆炸;
(4)BCl3的沸点为12.5℃,所以收集BCl3要用冰盐水冷却;
(5)BCl3发生水解反应生成硼酸和HCl;
(6)硼与铝的性质相似,也能与氢氧化钠溶液反应,所以可以用氢氧化钠与硼反应来检验产品中是否有硼粉.
解答 解:(1)根据装置A的药品和反应条件可知该装置是实验室制备氯气的装置,其中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)根据实验目的“某兴趣小组拟选用下列装置制备BCl3”,依据的原理是3Cl2+2B$\frac{\underline{\;\;△\;\;}}{\;}$2BCl3,所以装置连接的顺序应该为气体发生装置---除杂装置--反应装置--收集装置--尾气处理装置的顺序,又实验室制备氯气中夹杂有氯化氢和水,且应先除去HCl再除去水,按气流方向连接各装置的接口,顺序为A→C→E→B→D→E→F,BCl3易水解,所以实验前要先用氯气将装置中的空气排尽,所以要先点燃A处酒精灯,
故答案为:C→E→B→D→E;A;
(3)装置E是一个盛有碱石灰的干燥管,其作用一方面是吸收未反应的多余氯气,另一个方面也防止空气中的水蒸气进入U形管,实验中若不用装置C,则夹杂在氯气中的氯化氢也会进入盛有硼粉的玻璃管发生反应2B+6HCl$\frac{\underline{\;\;△\;\;}}{\;}$2BCl3+3H2↑,可能产生的危险是氢气和氯气混合气体受热易爆炸,
故答案为:防止空气中的水进入U形管;吸收多余的氯气;氢气与氯气混合受热易爆炸;
(4)BCl3的沸点为12.5℃,所以收集BCl3要用冰盐水冷却,所以D的作用是冷却和收集三氯化硼,
故答案为:冷却和收集三氯化硼;
(5)BCl3遇水产生大量的白雾,同时生成硼酸,是发生水解反应的原因,发生的方程式为BCl3+3H2O=3HCl+H3BO3,
故答案为:BCl3+3H2O=3HCl+H3BO3;
(6)硼与铝的性质相似,也能与氢氧化钠溶液反应,所以验证所得的产品中是否含有硼粉的方法是取少量产品于试管中,滴加浓氢氧化钠溶液,若有气泡产生,则样品中含有硼粉;若无气泡,则样品中无硼粉,
故答案为:取少量产品于试管中,滴加浓氢氧化钠溶液,若有气泡产生,则样品中含有硼粉;若无气泡,则样品中无硼粉.
点评 本题考查物质的制备实验,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意把握实验的原理和注意事项,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

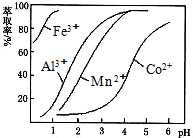
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15 | B. | 16 | C. | 17 | D. | 18 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
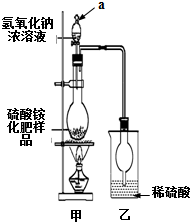 硫酸铵是一种常用的铵态氮肥.国家规定的质量标准如下:
硫酸铵是一种常用的铵态氮肥.国家规定的质量标准如下:| 指标 项目 | 优等品 | 一等品 | 合格品 |
| 外 观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥21.0% | ≥20.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -317.3kJ/mol | B. | +317.3 kJ/mol | C. | -379.3kJ/mol | D. | -332.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 适量摄入油脂,有助于人体吸收多种脂溶性维生素和胡萝卜素 | |
| B. | 利用油脂在碱性条件下的水解,可以生产甘油和肥皂 | |
| C. | 植物油通过氢化可以制造植物奶油(人造奶油) | |
| D. | 脂肪是有机体组织里储存能量的重要物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com