
| A. | 金属、非金属、稀有气体 | B. | 化合物、盐、酸式盐 | ||
| C. | 碱、碱性氧化物、碱式盐 | D. | 混合物、化合物、纯净物 |
分析 A、单质分为金属单质和非金属单质,所以金属、非金属是并列关系;
B、化合物包括酸、碱、盐、氧化物,盐分为正盐、酸式盐、碱式盐;
C、纯净物包含单质和化合物,化合物包括酸、碱、盐、氧化物,碱和氧化物是并列关系;
D、物质分为纯净物和混合物,所以纯净物和混合物是并列关系.
解答 解:A、单质分为金属单质和非金属单质,所以金属、非金属是并列关系,故A错误;
B、化合物包括酸、碱、盐、氧化物,盐分为正盐、酸式盐、碱式盐,后者从属于前者,故B正确;
C、化合物包括酸、碱、盐、氧化物,碱和氧化物是并列关系,故C错误;
D、物质分为纯净物和混合物,所以纯净物和混合物是并列关系,故D错误.
故选B.
点评 本题主要考查对 酸、碱、盐,纯净物和混合物,氧化物等考点的理解,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
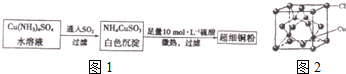
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L H2O含有的分子数为 NA | |
| B. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| C. | 将等物质的量的SO3和SO2溶于水,所得溶液中H+数目相等 | |
| D. | 常温常压下,1.06g Na2CO3溶于水形成的溶液中含有Na+离子数为0.02 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
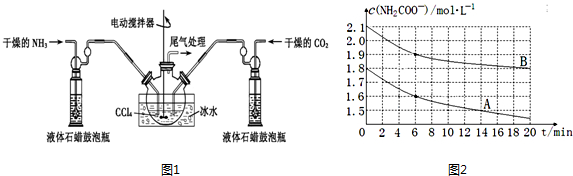
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液呈酸性说明草酸是弱酸 | B. | c(K+)+c(H+)═c(HC2O4-)+c(OH-)+2c(C2O42-) | ||
| C. | c(K+)>c(HC2O4-)>c(C2O42-)>c(H+) | D. | c(H2C2O4)>c(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
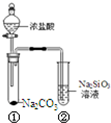
| A. | 向Na2SiO3溶液中滴入酚酞溶液无明显现象 | |
| B. | 试管①中反应的离子方程式是:Na2CO3+2H+═2Na++CO2↑+H2O | |
| C. | 该实验可以证明酸性:盐酸>碳酸>硅酸 | |
| D. | 若将盐酸换成硫酸,能证明酸性:硫酸>碳酸>硅酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl属于离子化合物 | B. | 原子团为OH-属于羟基 | ||
| C. | 乙醇与水混合后静置,不出现分层 | D. | 淀粉水解的最终产物含有葡萄糖 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com