
【题目】用如图所示装置进行Fe与水蒸气反应的实验,下列有关说法不正确的是

A. 装置A的作用是为实验提供持续不断的水蒸气
B. 装置B中反应的化学方程式是2Fe+3H2O![]() Fe2O3+3H2↑
Fe2O3+3H2↑
C. 装置C中加入的固体干燥剂可能是碱石灰
D. 点燃D处的气体前必须检验气体的纯度
科目:高中化学 来源: 题型:
【题目】近年来,硫化铜矿的湿法冶炼技术已经取得了很大的发展。现有一种催化氧化酸浸硫化铜矿的冶炼法,其工艺流程如图所示:

反应温度、固液比、反应时间、氯离子浓度都对铜的浸出率有较大的影响,下面是实验得出的这几种因素对铜的浸出率影响的变化曲线图(如图~如图所示)。

回答下列问题:
(1)火法炼铜的主要反应:①2CuFeS2+4O2![]() Cu2S+3SO2+2FeO(炉渣);
Cu2S+3SO2+2FeO(炉渣);
②2Cu2S+3O2![]() 2Cu2O+2SO2;③2Cu2O+Cu2S
2Cu2O+2SO2;③2Cu2O+Cu2S![]() 6Cu+SO2↑;则在反应①、②、③中被氧化的元素为_______(填元素符号);若生成的SO2在标准状况下体积为4.48L,则发生转移的电子数目为________NA;由amolCuFeS2生成amolCu,共消耗________molO2。
6Cu+SO2↑;则在反应①、②、③中被氧化的元素为_______(填元素符号);若生成的SO2在标准状况下体积为4.48L,则发生转移的电子数目为________NA;由amolCuFeS2生成amolCu,共消耗________molO2。
(2)写出反应1的化学方程式:________________。经查,硫黄、FeSO4·7H2O均可入药,用途广泛,湿法炼铜与火法炼铜相比,优点是_____________________。
(3)从溶液中得到FeSO4·7H2O晶体的操作是_______________________________。
(4)根据实验以及工业生产的实验要求,从下表中得出的最佳工艺条件为________(填字母代号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. 氨水中通入少量的SO2气体: SO2+ OH- == HSO3-
B. 氯气与水的反应: Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
C. 氯化钙溶液中通入CO2气体: Ca2++H2O+CO2== CaCO3↓+2H+
D. 二氧化锰跟浓盐酸共热制Cl2:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH <0,写出该反应的化学平衡常数表达式K=___________。降低温度,二氧化硫的转化率___________(填“增大”“ 减小”“ 不变”)。
2SO3(g) ΔH <0,写出该反应的化学平衡常数表达式K=___________。降低温度,二氧化硫的转化率___________(填“增大”“ 减小”“ 不变”)。
(2)Na2CO3溶液显___________(填“酸性”、“碱性”或“中性”),室温下,pH=10的溶液中,由水电离出的c(OH-)=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。

请回答下列问题:
(1)写出下列物质的化学式:B_________,乙_________,H_________
(2)根据要求回答:
1)D溶液和F溶液在空气中混合的现象:___________________________________;
2)反应③离子方程式___________________________________________________;
3)反应①离子方程式___________________________________________________;
4)反应⑥化学方程式___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.4kJ/mol起始反应物为N2和H2物质的量之比为1:3,且总物质的量不变,在不同压强和濫度下,反应达到平衡时体系中NH3的物质的量分数如下表:
2NH3(g)ΔH=-92.4kJ/mol起始反应物为N2和H2物质的量之比为1:3,且总物质的量不变,在不同压强和濫度下,反应达到平衡时体系中NH3的物质的量分数如下表:
温度 物质的量分数 压强 | 400℃ | 450℃ | 500℃ | 600℃ |
20MPa | 0.387 | 0.274 | 0.189 | 0.088 |
30MPa | 0.478 | 0.359 | 0.260 | 0.129 |
下列说法正确的是
A. 体系中NH3的物质的量分数越大,则正反应速率越大
B. 反应达到平衡时,N2和H2的转化率之比均为1
C. 反应达到平衡时,放出的热量均为92.4kJ
D. 600℃,30MPa下反应达到平衡时,生成NH3的物质的量最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是由乙烯合成乙酸乙酯的几种可能的合成路线:

(1)乙酸中官能团的结构简式是___。
(2)请写出反应涉及到的化学反应类型___________。
(3)请写出⑤反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)厨房中有下列用品:
A. 食盐 B. 小苏打 C. 纯碱 D. 食醋(主要成分为CH3COOH)。
①纯碱的化学式是___________;
②主要成分属于酸式盐的是___________(填序号);
③水溶液呈碱性的是___________(填序号);
④醋酸在水中的电离方程式是______________________。
(2)选择下列实验方法或操作分离物质,请将实验方法的序号填在横线上 (填序号)。
A. 萃取 B. 过滤 C. 蒸馏 D. 加热
①除去粗盐溶液中的泥沙___________;
②利用自来水制取蒸馏水___________;
③从碘水中提取碘___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求答题
I.NaNO2 因外观和食盐相似,又有咸味,容易使人误食中毒。已知 NaNO2能发生反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是 ________。
(2)根据上述反应,鉴别 NaNO2 和 NaCl。可选用的物质有①水、②碘化钾淀粉试纸③淀粉、④白酒、⑤食醋,你认为必须选用的物质有________(填序号)。
(3)请配平以下化学方程式:____Al+____NaNO3+____ NaOH= ____NaAlO2+____ N2↑+___H2O,________________,若反应过程中转移 5 mol 电子,则生成标准状况下 N2 的体积为_________L。
II.向100mL1.5mol/L的氢氧化钠溶液中缓慢通入一定量的CO2,反应后,向所得溶液中逐滴缓慢滴加一定浓度的盐酸,所得气体的体积与所加盐酸的体积(不考虑气体溶解于水)关系如图所示。
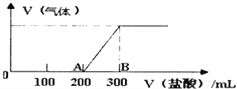
则:①氢氧化钠溶液与一定量的CO2充分反应后的溶液中溶质为____(写化学式)。
②盐酸的浓度为_______。
③B点时,产生的气体在标准状况下的体积为_______L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com