
【题目】工业上可用隔膜电解槽电解食盐水的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,如次氯酸钠等。根据题意完成下列计算:
(1)某氯碱厂测得某组电解槽的阳极每小时产生气体485.92m3(折算到标准状况,下同),合________________mol;测知其中Cl2的体积分数为0.985(杂质为O2),则该气体的密度为________________;阴极产生NaOH_________mol(保留四位有效数字,下同)。
(2)下表提供了两极溶液浓度的变化数据(阴阳两个极区的物料不流通,忽略其中溶液的体积变化)。
阴极:NaOH溶液质量分数 | 阳极:NaCl溶液浓度(g/L) | |
进料液 | 0.30 | 310 |
电解后 | 0.32 | 210 |
若某个电解槽每小时进NaOH溶液52.000 kg,得到碱溶液初产品90.416 kg,则阳极区每小时加入NaCl溶液_______________m3。取碱溶液初产品中的40% 加入一定量纯水,达到阴极进料液的浓度要求,则需要加入纯水_________________L。
(3)产品之一----漂水(NaClO溶液)具有良好的消毒、漂白能力。在制漂水过程中取1L溶液,测得pH=12(忽略水解),NaClO含量为0.3725g。在一定条件下,将该溶液制成晶体,质量最多为1.335g。通过列式计算,写出该晶体的化学式_________________。
【答案】2.169×104 3.144g/L 4.273×104 0.1950 2.411 NaCl NaClO 2NaOH 3H2O
【解析】
(1)电解食盐水,2NaCl+2H2O==Cl2↑+H2↑+2NaOH,阳极发生氧化反应,产生氯气,阴极发生还原反应,产生氢气,在阴极产生氢氧化钠的物质的量是氯气的2倍;
(2)溶液中氢氧化钠质量增重为电解得到的氢氧化钠,根据溶液质量与氢氧化钠的质量分数计算电解生成的氢氧化钠质量,阳极减少的氯化钠质量与阴极生成的氢氧化钠质量相等;稀释时氢氧化钠质量不变,计算稀释后溶液质量,再计算需要水的质量,进而计算需要加水体积;
(3)利用氯气与氢氧化钠反应制备氯水,有氯化钠生成,溶液显碱性,说明有氢氧化钠剩余,计算溶液中的氢氧化钠浓度,进而计算氢氧化钠的物质的量,计算次氯酸钠的质量,根据电荷转移守恒计算氯化钠的物质的量,根据晶体质量判断晶体是否有水存在。
(1)阳极每小时产生气体485.92m3,即485920L,在标准状况下,![]() mol;测知其中Cl2的体积分数为0.985,即产生氯气的物质的量为2.137×104mol,阴极产生NaOH为4.273×104mol,则该气体的密度为
mol;测知其中Cl2的体积分数为0.985,即产生氯气的物质的量为2.137×104mol,阴极产生NaOH为4.273×104mol,则该气体的密度为![]() ;
;
(2)溶液中氢氧化钠质量增重为电解得到的氢氧化钠,故反应产生的氢氧化钠质量为90.416kg×0.32-52.000kg×0.30=13.333kg,阳极减少的氯化钠物质的量与阴极产生的氢氧化钠物质的量相同,则阳极减少的氯化钠质量为13.333kg×![]() =19.500kg,每小时加入的氯化钠溶液体积为
=19.500kg,每小时加入的氯化钠溶液体积为![]() ,加入的水的体积为
,加入的水的体积为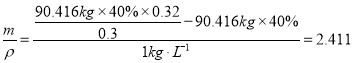 ;
;
(3)利用氯气与氢氧化钠反应制备漂白水,溶液有氢氧化钠剩余,pH=12,即氢氧化钠浓度为0.01mol/L,氢氧化钠物质的量为0.01mol;次氯酸钠含量为0.3725g,物质的量为0.005mol,根据电子转移守恒可知,生成氯化钠为0.005mol,则![]() ,即晶体中含有水,质量为1.335g-1.065g=0.27g,水的物质的量为0.015mol,综上所述,晶体结构为NaCl NaClO 2NaOH 3H2O。
,即晶体中含有水,质量为1.335g-1.065g=0.27g,水的物质的量为0.015mol,综上所述,晶体结构为NaCl NaClO 2NaOH 3H2O。


科目:高中化学 来源: 题型:
【题目】破坏(或形成)1 mol化学键所吸收(或放出)的能量称为键能。已知 H—H 键的键能为 436 kJ·mol-1,O=O键的键能为 498 kJ·mol-1, H2(g)+![]() O2(g)=H2O(l) ΔH=-286 kJ·mol-1 , 则 H2O 分子中 O—H 键的键能为( )
O2(g)=H2O(l) ΔH=-286 kJ·mol-1 , 则 H2O 分子中 O—H 键的键能为( )
A.485.5 kJ·mol-1 B.610 kJ·mol-1 C.917 kJ·mol-1 D.1 220 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟电化学反应装置图。下列说法正确的是
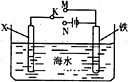
A.若X为碳棒,开关K置于N处,可以加快铁的腐蚀
B.若X为碳棒,开关K置于N处,则X极附近溶液变黄色
C.若X为锌,开关K置于M处,保护铁电极则为牺牲阳极的阴极保护法
D.若X为锌,开关K置于M处,则X电极的反应式为:O2+4e+2H2O→4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能源是最具应用前景的能源之一,高纯氢的制备时目前的研究热点。某工艺利用电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2.下列有关描述不合理的是
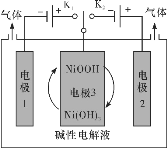
A.制H2时,产生H2的电极反应式:2H2O+2e-=H2↑+2OH-
B.制O2时,电极3要连接K2
C.若没有电极3,K1和K2直接相连,一样可以得到H2和O2
D.上述过程,若用酸性电解质一样可以实现上述过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物)。请填写下列空白:

(1)检验乙醛的试剂是_________;(选填编号)
a.银氨溶液 b.碳酸氢钠溶液 c.新制氢氧化铜 d.氧化铜
(2)乙醇发生催化氧化的化学反应方程式为____________;
(3)实验开始时,是先鼓入空气还是先点燃酒精灯加热铜丝?_____________,原因是_________;该实验中“鼓气速度”这一变量你认为可用______来估量;
(4)实验时,常常将甲装置浸在70℃~80℃的水浴中,目的是_______。以下实验需要水浴加热的是_________;(选填编号)
a.卤代烃水解 b.银镜反应 c. 乙酸丁酯 d.苯的硝化反应
(5)该课外活动小组偶然发现向溴水中加入乙醛溶液,溴水褪色(假设两者恰好完全反应)。该同学为解释上述现象,提出两种猜想:① 溴水将乙醛氧化为乙酸;② 溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确?__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定草酸晶体H2C2O4·xH2O中的x值,某实验小组进行实验,步骤如下:
①称取1.260 g草酸晶体,配成100 mL溶液。
②取25.00 mL该H2C2O4溶液加入锥形瓶内,再加入适量稀硫酸。
③用浓度为0.1000 mol/L的KMnO4溶液滴定H2C2O4溶液,当__________________时,滴定结束。
④记录数据,重复实验。整理数据如:
实验序号 | V(KMnO4溶液) | |
滴定前刻度/mL | 滴定后刻度/mL | |
1 | 0.10 | 10.00 |
2 | 1.10 | 11.10 |
3 | 1.50 | 11.50 |
回答下列问题:
(1)步骤①需使用烧杯、量筒、玻璃棒,还缺少的玻璃仪器为______________(填名称);步骤③滴定过程中,盛装KMnO4溶液的仪器为_______________(填名称)。
(2)该反应原理的化学方程式为_____________________________________________。
(3)请将步骤③补充完整_____________________________________________________。
(4)根据数据,计算H2C2O4溶液的物质的量浓度为_________mol/L,x=________。
(5)若滴定终点读数时俯视KMnO4溶液液面,则x值会_________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某只含铁、氧两种元素的样品A,高温时与足量的CO充分反应,生成的气体被足量澄清石灰水吸收,测得沉淀的质量与原样品A质量相等。如果A中只含两种物质,则A中一定含有( )
A. FeO B. Fe2O3 C. Fe3O4 D. Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。则下列说法中正确的是
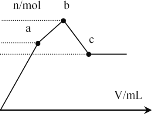
A.a点的溶液呈中性
B.b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓
C.c点溶液呈碱性
D.c点加入Ba(OH)2溶液的体积为200 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
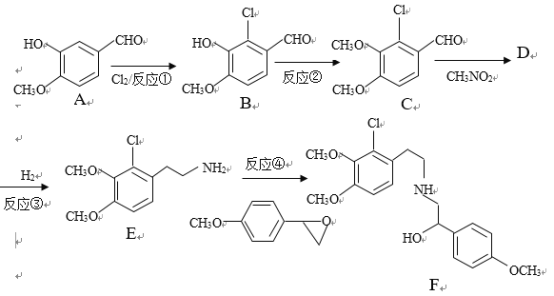
【题目】某药物合成中间体F制备路线如下:
已知:RCHO+R’CH2NO2![]()
 +H2O
+H2O
(1)有机物A结构中含氧官能团的名称是__________________.
(2)反应②中除B外,还需要的反应物和反应条件是___________________
(3)有机物D的结构简式为_____________________,反应③中1摩尔D需要___摩尔H2才能转化为E
(4)反应④的反应物![]() 很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式_____________。
很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式_____________。
a.结构中含4种化学环境不同的氢原子
b.能发生银镜反应
c.能和氢氧化钠溶液反应
(5)已知:苯环上的羧基为间位定位基,如![]()
![]()
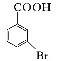 。写出以
。写出以![]() 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂任选)_____________。
的合成路线流程图(无机试剂任选)_____________。
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com