
A、B、D、E四种元素均为短周期元素,原子序数逐渐增大。A元素原子的核外电子数、电子层数和最外层电子数均相等。B、D、E三种元素在周期表中的相对位置如图①所示,只有E元素的单质能与水反应生成两种酸。甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的10电子分子,溶于水显碱性;甲、乙为非金属单质;X分子含有10个电子,常温下为无色液体。它们之间的转化关系如图②所示。
| B | D | |
| E |
图①

请回答下列问题:
(1) Z的化学式为__________________
(2)乙的电子式为__________________。
(3)惰性电极电解NaE溶液的离子方程式为__________________________。
(4)W与甲反应方程式为__________________。
(5)将一定量的A2、B2的混合气体放入1 L密闭容器中,在500 ℃、2×107 Pa下达到平衡。测得平衡气体的总物质的量为0.50 mol,其中A2为0.3 mol,B2为0.1 mol。则该条件下A2的平衡转化率为________,该温度下的平衡常数为________(结果保留3位有效数字)。
科目:高中化学 来源: 题型:
下表为长式周期表的一部分,其中的编号代表对应的元素。
| ① | |||||||||||||||||
| ② | ③ | ||||||||||||||||
| ④ | ⑤ | ⑥ | ⑦ | ||||||||||||||
| ⑧ | ⑨ | ⑩ |
请回答下列问题:
(1)表中属于d区的元素是 (填元素符号),价电子(外围电子)排布式为 。
(2)④ ⑤ ⑥ ⑦四种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
(3)按原子轨道的重叠方式,③与⑥形成的化合物中,其中③的杂化方式为 ;
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ;该元素与元素①形成的10电子分子X属于 分子(填“极性”或“非极性”)。
(5)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式: 。
(6)1183 K以下⑨元素形成的晶体的基本结构单元如图1所示,1183 K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的原子间距离相同。
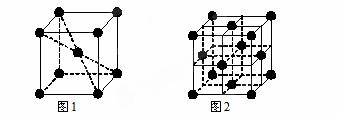
在1183 K以下的晶体中,与⑨原子等距离且最近的⑨原子数为______个,在1183 K以上的晶体中,与⑨原子等距离且最近的⑨原子数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:CO+H2O CO2+H2,在—定温度下,容器中加入CO和H2O(g)各lmol,达到平衡时生成0.7mol的CO2,若其他条件不变,再加4molH2O(g),再达到平衡时可能生成CO2为( )
CO2+H2,在—定温度下,容器中加入CO和H2O(g)各lmol,达到平衡时生成0.7mol的CO2,若其他条件不变,再加4molH2O(g),再达到平衡时可能生成CO2为( )
A.0.6mol B.0.95mol C.1mol D.1.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列叙述正确的是( )
A.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
B.2 L0.5 mol • L-1硫酸钾溶液中阴离子所带电荷数为NA
C.1 mol Na2O2固体中含离子总数为4NA
D. 5NH4NO3 2HNO3+4N2↑+9H2O反应中,生成28 gN2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 gN2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.过氧化钠、烧碱、纯碱分别属于碱性氧化物、碱、盐
B.Na、Al、Cu可以分别用热还原法、热分解法和电解冶炼法得到
C.天然气、沼气和液化石油气分别属于化石能源、不可再生能源和二次能源
D.氯化银、冰醋酸、酒精、水银分别属于强电解质、弱电解质、非电解质、既不是电解质也不是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式是( )
A.浓盐酸与铁屑反应:2Fe+6H+===2Fe3++3H2↑
B.钠与CuSO4溶液反应:2Na+Cu2+===Cu↓+2Na+
C.NaHCO3溶液与稀H2SO4反应:CO +2H+===H2O+CO2↑
+2H+===H2O+CO2↑
D.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+===2Fe(OH)3+3Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
某一反应体系中的物质有HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,其中As是产物之一:
(1)写出并配平该反应的化学方程式:________________________________________________________________________
________________________________________________________________________。
(2)在该反应中,得电子的物质是 H3AsO3 (填化学式),被氧化的元素是 Sn (填元素符号)。
(3)在该反应中,每转移1 mol电子,消耗(生成)HCl 2 mol。
(4)下列叙述正确的是 AC (填序号)。
A.在相同条件下,ⅦA族元素阴离子的还原性从上到下逐渐增强
B.Sn和Pb位于同一主族,其+4价的化合物均很稳定
C.在相同条件下,还原性顺序为S2->I->Fe2+>Br->Cl-
D.在上述反应中,氧化性SnCl2>As,还原性H3AsO3>H2SnCl6
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
| 实验步骤 | 实验现象 |
| ① 将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。 |
| ② 向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③ 将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| ④ 将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体。 |
| ⑤ 将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥ 向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀。 |
请你帮助该同学整理并完成实验报告。
(1)实验内容:(填写与实验步骤对应的实验现象的编号和②③的化学方程式)
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) |
(2)填写编号③④⑤的化学方程式
实验③
实验④ ,
实验⑤ ;
(2)实验结论: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com