
分析 (1)根据Cl-的特征反应,可用硝酸酸化的硝酸银鉴别,根据NaNO2遇酸分解放出NO2,可用盐酸鉴别;
(2)根据NO2-的氧化性和I-的还原性,可以写出NO2-与HI反应的离子方程式;
(3)使NaNO2中的氮转化为对空气无污染的气体(氮气),需要另一种反应物具有还原性,只有NH4Cl符合;
(4)根据2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑可知n(OH-)=2n(H2)=0.3 mol.
解答 解:(1)根据Cl-的特征反应,可用硝酸酸化的硝酸银鉴别,根据NaNO2遇酸分解放出NO2,可用盐酸鉴别,故选:bc;
(2)根据NO2-的氧化性和I-的还原性,可以写出NO2-与HI反应生成碘单质和一氧化氮,所以离子方程式为2NO2-+2I-+4H+=I2+2NO↑+2H2O,故答案为:2NO2-+2I-+4H+=I2+2NO↑+2H2O;
(3)因NaNO2转化为不引起污染的N2的过程中N的化合价降低,另一物质化合价必升高,
故答案为:b;
(4)电解食盐水的离子方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-;标准状况下生成3.36L H2,所以$\frac{3.36L}{22.4L/mol}$=0.15mol,而n(OH-)=2n(H2)=0.15mol×2=0.3 mol,故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-;0.3 mol.
点评 本题主要结合亚硝酸盐考查了氧化还原反应的知识,考查的方式比较灵活,能较好的体现学生运用知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 酸性KMnO4与H2C2O4溶液反应时,加入少量的MnSO4 | |
| B. | Zn与H2SO4溶液反应时,加入少的CuSO4晶体 | |
| C. | Cu 丝与浓H2SO4溶液反应时,将Cu丝做成螺旋状 | |
| D. | 铁丝能与水蒸气反应,不与冷水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| NaCl | AlCl3 | SiCl4 | 碳化铝 | |
| 熔点 | 810℃ | 190℃ | -68℃ | 2200℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 磷单质及其化合物在工业上有广泛应用.磷最重要的矿物资源是磷灰石,磷灰石主要有氟 磷灰石和羟基磷灰石.氟磷灰石在高温下制备白磷的化学方程式为:4Ca5 (P04)3F+21Si02+30C═3P4+20CaSi03+30CO+SiF4,结合上述反应中涉及到的物质或元素回答相关问题:
磷单质及其化合物在工业上有广泛应用.磷最重要的矿物资源是磷灰石,磷灰石主要有氟 磷灰石和羟基磷灰石.氟磷灰石在高温下制备白磷的化学方程式为:4Ca5 (P04)3F+21Si02+30C═3P4+20CaSi03+30CO+SiF4,结合上述反应中涉及到的物质或元素回答相关问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
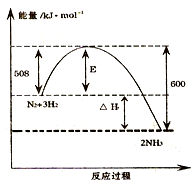 如图表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答:
如图表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答: 2NH3(g)△H=-92kJ/mol.
2NH3(g)△H=-92kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3+CaCl2═CaCO3↓+2NaCl | B. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O | ||
| C. | Fe+CuSO4═Cu+FeSO4 | D. | CaO+H2O═Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com