
【题目】某研究小组用如图所示装置制取乙酸乙酯,相关信息及实验步骤如下。

物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
乙醇 | -117.3 | 78.5 | 0.789 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
浓硫酸(98%) | — | 338.0 | 1.84 |
实验步骤:①在试管a中加入浓硫酸,乙醇和冰醋酸各2ml;②将试管a固定在铁架台上;③在试管b中加入适量的饱和碳酸钠溶液;④按图连接好装置后,用酒精灯对试管a缓慢加热(小火均匀加热) ;⑤待试管b收集到一定量产物后停止加热,撤去试管b并用力震荡试管b,然后静置。请回答下列问题:
(1)写出制取乙酸乙酯的化学方程式(注明反应条件):___________;
(2)装置中的球形干燥管除起冷凝作用外,它的另一重要作用是_____________________;
(3)试管b中饱和碳酸钠溶液的作用是___________(填选项);
A.中和乙酸并吸收部分乙醇 B.中和乙酸和乙醇
C.降低乙酸乙酯的溶解度,有利于分层析出 D.加速酯的生成,提高其产率
(4) 步骤④中需要用小火均匀加热,其主要原因是_________________________________________;
(5)指出步骤⑤静置后,试管b中所观察到的实验现象:___________________________________;
(6)下图是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图:

在上述实验过程中,所涉及的三次分离操作是___________(填选项)。
A.①蒸馏②过滤③分液 B. ①分液②蒸馏③结晶、过滤
C.①蒸馏②分液③分液 D.①分液②蒸馏③蒸馏
【答案】CH3COOH+C2H5OH![]() CH3COOC2H5+H2O防止倒吸AC减少原料损失(或减少副产物生成,答案合理均可)b中液体分层,上层是透明有香味的油状液体D
CH3COOC2H5+H2O防止倒吸AC减少原料损失(或减少副产物生成,答案合理均可)b中液体分层,上层是透明有香味的油状液体D
【解析】
本题主要考察乙酸乙酯的制备实验的相关知识。
(1)实验室中用乙醇、乙酸在浓硫酸、加热的条件下制备乙酸乙酯,反应的化学方程式为CH3COOH+C2H5OH![]() CH3COOC2H5+H2O ;(2)如果反应结束后先移开酒精灯,仪器中的压强减小,试管中的溶液变会倒吸到反应器中,发生危险,因此装置中的球形干燥管除起冷凝作用外,它的另一重要作用是防倒吸;(3)饱和碳酸钠溶液的作用主要有3个①使混入乙酸乙酯中的乙酸与Na2CO3反应而除去;②使混入的乙醇溶解;③使乙酸乙酯的溶解度减小,减少其损耗及有利于它的分层和提纯,故选AC。(4)根据各物质的沸点数据可知,乙酸(117.9℃)、乙醇(78.0℃)的沸点都比较低,且与乙酸乙酯的沸点(77.5℃)比较接近,若用大火加热,反应物容易随生成物(乙酸乙酯)一起蒸出来,导致原料的大量损失,所以应小火均匀加热,防止温度过高;(5)反应后试管中的到产物为乙酸乙酯,乙酸乙酯为无色有香味油状液体,不溶于水,密度小于水,根据此性质可知b中液体分层,上层是透明有香味的油状液体;(6)乙醇、乙酸和乙酸乙酯混合物种加入饱和碳酸钠溶液,乙醇溶于水层,乙酸与碳酸钠反应溶于水中,乙酸乙酯不溶于水,位于水层之上。两种不互溶液体的分离应采用分液的方法;溶液A中溶有乙醇,根据乙醇和水的沸点不同,可用蒸馏法分离乙醇;向剩余溶液中加入硫酸,溶液中生成乙酸,再根据乙酸与水的沸点不同,可用蒸馏方法分离乙酸。
CH3COOC2H5+H2O ;(2)如果反应结束后先移开酒精灯,仪器中的压强减小,试管中的溶液变会倒吸到反应器中,发生危险,因此装置中的球形干燥管除起冷凝作用外,它的另一重要作用是防倒吸;(3)饱和碳酸钠溶液的作用主要有3个①使混入乙酸乙酯中的乙酸与Na2CO3反应而除去;②使混入的乙醇溶解;③使乙酸乙酯的溶解度减小,减少其损耗及有利于它的分层和提纯,故选AC。(4)根据各物质的沸点数据可知,乙酸(117.9℃)、乙醇(78.0℃)的沸点都比较低,且与乙酸乙酯的沸点(77.5℃)比较接近,若用大火加热,反应物容易随生成物(乙酸乙酯)一起蒸出来,导致原料的大量损失,所以应小火均匀加热,防止温度过高;(5)反应后试管中的到产物为乙酸乙酯,乙酸乙酯为无色有香味油状液体,不溶于水,密度小于水,根据此性质可知b中液体分层,上层是透明有香味的油状液体;(6)乙醇、乙酸和乙酸乙酯混合物种加入饱和碳酸钠溶液,乙醇溶于水层,乙酸与碳酸钠反应溶于水中,乙酸乙酯不溶于水,位于水层之上。两种不互溶液体的分离应采用分液的方法;溶液A中溶有乙醇,根据乙醇和水的沸点不同,可用蒸馏法分离乙醇;向剩余溶液中加入硫酸,溶液中生成乙酸,再根据乙酸与水的沸点不同,可用蒸馏方法分离乙酸。


科目:高中化学 来源: 题型:
【题目】(1)地下钢管连接镁块是金属防腐措施中的________________________法。
(2)铅及其化合物可用于蓄电池,耐酸设备及X射线防护材料等。回答下列问题:
①铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为_______________________;铅的最高价氧化物对应水化物的酸性比碳酸的_______(填“强”或“弱”)。
②PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为___________________________。
③铅蓄电池放电时的正极反应式为__________________________________________ ,当电路中有2mol电子转移时,理论上两电极质量变化的差为_______ g。
(3)NO2、O2和熔融NaNO3可制作燃料电池,其原理见下图,石墨Ⅰ为电池的________极;该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,其电极反应式为__________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,HCl作氧化剂的是( )
A.NaOH+HCl=NaCl+H2O
B.Zn+2HCl=ZnCl2+H2↑
C.MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
D.CuO+2HCl=CuCl2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述不正确的是( )

A. 铜电极上发生还原反应
B. 电池工作一段时间后,c(SO42-)向锌电极移动,甲池的c(SO42-)增大
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 电流的方向:由铜电极经过导线流向锌电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国里昂的科学家最近发现一种只由四个中子组成的微粒,这种微粒称为“四中子”,也有人称之为“零号元素”.它与天体中的中子星构成类似.有关:“四中子”微粒的说法正确的( )
A.该微粒的质量数为2
B.该微粒不显电性
C.它与普通中子互称为同位素
D.在元素周期表中与氢元素占同一位置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu、Fe、Se、Co、Si常用于化工材料的合成。请回答下列问题:
(1)铁离子(Fe3+)最外层电子排布式为______,其核外共有______种不同运动状态的电子。Fe3+比Fe2+更稳定的原因是____________________________________。
(2)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的电负性从大到小的顺序为________(用元素符号表示)。
(3)Na3[Co(NO2)6]常用作检验K+的试剂,在[Co(NO2)6]3-中存在的化学键有____、_____。
(4)C与N能形成一种有毒离子CN-,能结合Fe3+形成配合物,写出一个与该离子互为等电子体的极性分子的分子式_____,HCN分子的空间构型为____________。
(5)单晶硅的结构与金刚石的结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子间不成键,则得如图所示的金刚砂(SiC)结构。
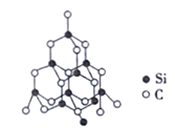
在SiC晶体中,C原子的杂化方式为_________,每个Si原子被_______个最小环所共有。
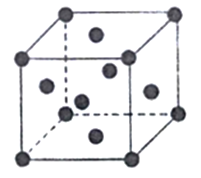
(6)已知Cu的晶胞结构如图,棱长为acm,又知Cu的密度为pg/cm3,则用a、p的代数式表示阿伏伽德罗常数为____mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别进行下列操作,由现象得出的结论正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 滴加Ba(NO3)2和HNO3混合溶液 | 生成白色沉淀 | 原溶液中有SO42- |
B | 将乙烯通入溴水中 | 溴水褪色 | 乙烯与溴水发生氧化反应 |
C | 分别将少量钠投入到盛有水和乙醇的烧杯中 | 盛水烧杯中反应剧烈 | 水中的氢比乙醇中的氢活泼性强 |
D | 滴加NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有Cl-、CO32-、SO42-三种阴离子,如果只取一次溶液,分别将三种离子检验出来,下列加入试剂及其顺序(从左至右)正确的是( )
A.氯化钡溶液、硝酸、硝酸银溶液B.硝酸、硝酸银溶液、氯化钡溶液
C.硝酸、硝酸钡溶液、硝酸银溶液D.稀硫酸、硝酸钡溶液、硝酸银溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com