
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x的值:__________________(列出计算过程)。
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为__________。在实验室中,FeCl2可用铁粉和__________反应制备,FeCl3可用铁粉和__________反应制备。
答案 (1)n(Cl)=0.025 0 L×0.40 mol·L-1=0.010 mol
0.54 g-0.010 mol×35.5 g·mol-1=0.185 g
n(Fe)=0.185 g/56 g·mol-1≈0.003 3 mol
n(Fe)∶n(Cl)=0.003 3∶0.010≈1∶3,x=3
(2)0.10 盐酸 氯气
解析 解答此题的关键是明确阴离子交换柱交换出的OH-的物质的量等于Cl-的物质的量,从而求出FeClx中x的值。
(1)首先明确阳离子交换柱和阴离子交换柱的作用,根据离子等量交换,溶液中OH-的物质的量等于FeClx中Cl-的物质的量。通过中和滴定知n(OH-)=n(H+)=0.40 mol·L-1×25.0×10-3 L=0.010 mol,故n(Cl-)=0.010 mol。
FeClx中Fe元素的质量为0.54 g-35.5 g·mol-1×0.010 mol=0.185 g
FeClx中Fe元素与Cl元素的物质的量之比为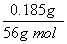 ∶0.010 mol≈1∶3,故x=3。
∶0.010 mol≈1∶3,故x=3。
(2)根据题意可设该混合物的组成为FeCl2.1,利用十字交叉法可得样品中FeCl3的物质的量分数为0.10。注意制备FeCl2选用弱氧化剂,制备FeCl3选用强氧化剂。


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
关于FeCl3进行的实验,下列预测正确的是( )
| 选项 | 实验 | 预测 |
| A | 蒸发FeCl3溶液 | 得到FeCl3固体 |
| B | 在FeCl3、CuCl2混合液中,加入少量Fe粉 | 一定有H2产生且有Cu析出 |
| C | 用FeCl3固体溶于水配制饱和溶液 | 会有Fe(OH)3沉淀产生 |
| D | 在FeCl3溶液中加入KHCO3溶液 | 有CO2产生,但无Fe(OH)3沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子在指定溶液中能大量共存的是( )
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO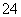
B.1.0 mol·L-1的FeCl2溶液:NO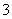 、Na+、K+、ClO-
、Na+、K+、ClO-
C.使酚酞变红的溶液中:Na+、Cl-、SO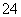 、Fe3+
、Fe3+
D.酸性溶液中:NO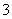 、SO
、SO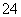 、Fe3+、Mg2+
、Fe3+、Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示金属活动性顺序表中铜、锡、铁和铝元素被人类大规模开发、利用的大致年限。
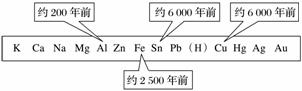
根据上图回答下列问题。
(1)铝是地壳中含量最高的金属元素,为什么人类对铝的使用比铁、铜晚得多?
查看答案和解析>>
科目:高中化学 来源: 题型:
用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:
2Al+4BaO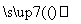 3Ba↑+BaO·Al2O3
3Ba↑+BaO·Al2O3
常温下Al的金属性比Ba的金属性______(选填“强”、“弱”)。利用上述方法可制取Ba的主要原因是______。
A.高温时Al的活泼性大于Ba
B.高温有利于BaO分解
C.高温时BaO·Al2O3比Al2O3稳定
D.Ba的沸点比Al的低
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同回答下列问题:
探究一 设计如图所示装置进行“铁与水反应”的实验(夹持仪器略)。
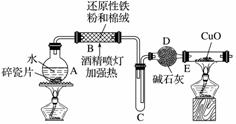
(1)硬质玻璃管B中发生反应的化学方程式为__________________________________。
(2)反应前A中投放碎瓷片的目的是___________________________________________。
(3)装置E中的现象是______________________________________。
探究二 设计如下实验方案确定反应后硬质玻璃管B中黑色固体的成分。
(4)待硬质玻璃管B冷却后,取少许其中的固体物质溶于________后,将所得溶液分成两份。
(5)一份滴加几滴KSCN溶液。若溶液变血红色,推断硬质玻璃管B中固体物质的成分为________(选填序号,下同);若溶液未变血红色,推断硬质玻璃管B中固体物质的成分为________。
①一定有Fe3O4 ②一定有Fe
③只有Fe3O4 ④只有Fe
(6)另一份用__________(填仪器名称)加入________(填试剂和现象),可以证明溶液中存在Fe2+。
探究三 设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。
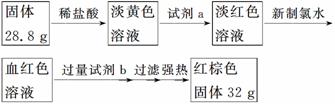
(7)试剂b的化学式是________。
(8)计算反应后B装置中铁元素的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
在0.1mol/L的CH3COOH溶液中存在如下电离平衡: ( )
CH3COOH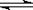 CH3COO-+H+ ,对于该平衡,下列叙述正确的是
CH3COO-+H+ ,对于该平衡,下列叙述正确的是
A.加入少量NaOH固体,平衡向正反应方向移动
B.加水,反应速率增大,平衡向逆反应方向移动
C.滴加少量0.1mol/LHCl溶液,溶液中C(H+)减少
D.加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com