
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
| 试剂 | 实验现象 | |
| 方案1 | b | 四氯化碳层呈无色 |
| 方案2 | d | 溶液变红色 |
| 试剂 | 实验现象 | |
| 方案1 | b | 四氯化碳层呈无色 |
| 方案2 | d | 溶液变红色 |


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
| A、可用丁达尔现象区分葡萄糖溶液和淀粉胶体 |
| B、生石灰与水混合的过程只发生物理变化 |
| C、O3是由3个氧原子构成的化合物 |
| D、CuSO4?5H2O是一种混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
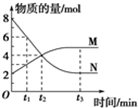 一定温度下,在2L的恒容密闭容器内发生的反应中M、N的物质的量随反应时间变化的曲线如图所示.
一定温度下,在2L的恒容密闭容器内发生的反应中M、N的物质的量随反应时间变化的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某恒温密闭容器发生可逆反应M (?)+N(?)═Q(g)+P(?)△H,如图所示,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列说法中正确的是( )
某恒温密闭容器发生可逆反应M (?)+N(?)═Q(g)+P(?)△H,如图所示,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列说法中正确的是( )| A、M和N在该条件下至少有一种是气态 |
| B、t2时刻后该可逆反应向逆反应方向进行,P的浓度一定减小 |
| C、若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大 |
| D、若在该温度下此反应平衡常数表达式为K=c(Q),则t1~t2时间段与t3时刻后的Q浓度不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、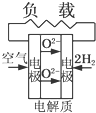 固体氧化物燃料电池 |
B、 碱性氢氧燃料电池 |
C、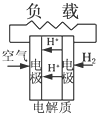 质子交换膜燃料电池 |
D、 熔融盐燃料电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应速率变化时,化学平衡一定发生移动 |
| B、化学平衡发生移动时,化学反应速率一定变化 |
| C、正反应进行的程度大,正反应速率一定大 |
| D、改变压强,化学反应速率一定改变,平衡一定移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com