
【题目】B和Mg在材料科学领域有广泛的应用和发展前景。
回答下列问题:
(1)下列B原子轨道表达式表示的状态中,能量更高的是________![]() 填“A”或“B”
填“A”或“B”![]() 。
。
A. ![]() B.
B. ![]()
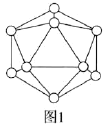
(2)晶体硼中的基本单元如图1所示,其中含有12个B原子。![]() 该单元中含有
该单元中含有![]() 键的数目为________。
键的数目为________。
(3)![]() 是重要的还原剂。其中阴离子的立体构型为________,中心原子的杂化形式为________。
是重要的还原剂。其中阴离子的立体构型为________,中心原子的杂化形式为________。
(4)基态Mg原子的核外电子排布式为________;第三周期主族元素中,电负性小于Mg元素的有________![]() 填元素符号,下同
填元素符号,下同![]() ,原子第一电离能小于Mg原子的有________。
,原子第一电离能小于Mg原子的有________。
(5)![]() 和
和![]() 均可作为耐火材料,其原因是________。
均可作为耐火材料,其原因是________。
(6)![]() 常用于光学仪器,其长方体型晶胞结构如图2所示:
常用于光学仪器,其长方体型晶胞结构如图2所示:
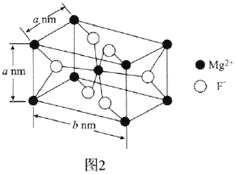
![]() 的配位数为________。
的配位数为________。
![]() 若阿伏加德罗常数的值为
若阿伏加德罗常数的值为![]() ,则
,则![]() 晶体的密度可表示为________
晶体的密度可表示为________![]() 用含a、b、
用含a、b、![]() 的代数式表示
的代数式表示![]() 。
。
【答案】![]()
![]() 正四面体形
正四面体形 ![]()
![]() 或
或![]() Na Na、Al
Na Na、Al ![]() 和
和![]() 的化学性质非常稳定,均为离子晶体,均具有很高的晶格能,故其熔点很高,可以作为耐火材料
的化学性质非常稳定,均为离子晶体,均具有很高的晶格能,故其熔点很高,可以作为耐火材料 ![]()
![]()
【解析】
(1)根据能量最低原理分析;
![]() 由图1知,1个B原子形成5个
由图1知,1个B原子形成5个![]() 键;
键;
![]() 中B原子的价层电子对数为
中B原子的价层电子对数为![]() =4,孤电子对数为0;
=4,孤电子对数为0;
![]() 元素的原子序数为12,根据能量最低原理书写核外电子排布式;同周期元素从左到右电负性增大,第一电离能逐渐增大,但ⅡA族元素s能级全充满,ⅢA族元素P能级有1个电子,所以第ⅡA族、第ⅢA族第一电离能反常;
元素的原子序数为12,根据能量最低原理书写核外电子排布式;同周期元素从左到右电负性增大,第一电离能逐渐增大,但ⅡA族元素s能级全充满,ⅢA族元素P能级有1个电子,所以第ⅡA族、第ⅢA族第一电离能反常;
(5)离子半径越小、离子带电荷数越多,晶格能越大。
![]() 由晶胞结构知,
由晶胞结构知,![]() 的配位数为6;
的配位数为6;
![]() 晶体的密度=晶胞的摩尔质量÷(晶胞的体积×
晶体的密度=晶胞的摩尔质量÷(晶胞的体积×![]() )
)
![]() 项表示的是基态,B项表示的是激发态,激发态能量高于基态。
项表示的是基态,B项表示的是激发态,激发态能量高于基态。
![]() 由图1知,1个B原子被5个
由图1知,1个B原子被5个![]() 键共用,
键共用,![]() 该单元中含有
该单元中含有![]() 原子,含有
原子,含有![]() 键的物质的量为
键的物质的量为![]() ,数目为
,数目为![]() 。
。
![]() 中B原子的价层电子对数为4,孤电子对数为0,该离子的立体构型为正四面体形,其中B原子的杂化形式为
中B原子的价层电子对数为4,孤电子对数为0,该离子的立体构型为正四面体形,其中B原子的杂化形式为![]() 。
。
![]() 元素的原子序数为12,则基态Mg原子的核外电子排布式为
元素的原子序数为12,则基态Mg原子的核外电子排布式为![]() 或
或![]() 。同周期主族元素从左到右非金属性逐渐增强,电负性逐渐增大,故第三周期主族元素中,电负性小于Mg元素的只有Na;原子的第一电离能从左到右呈增大趋势,其中第ⅡA族、第ⅢA族反常,故第一电离能小于Mg原子的有Na、Al。
。同周期主族元素从左到右非金属性逐渐增强,电负性逐渐增大,故第三周期主族元素中,电负性小于Mg元素的只有Na;原子的第一电离能从左到右呈增大趋势,其中第ⅡA族、第ⅢA族反常,故第一电离能小于Mg原子的有Na、Al。
![]() 离子晶体的熔、沸点高低用晶格能大小比较,晶格能大小主要取决于离子半径和离子所带电荷数。
离子晶体的熔、沸点高低用晶格能大小比较,晶格能大小主要取决于离子半径和离子所带电荷数。![]() 半径大于
半径大于![]() 、所带电荷数小于
、所带电荷数小于![]() ,故MgO的晶格能小于
,故MgO的晶格能小于![]() ,熔点低于
,熔点低于![]() 。
。
![]() 由晶胞结构知,
由晶胞结构知,![]() 的配位数为6。
的配位数为6。
![]() 由晶胞结构知,每个晶胞中含有
由晶胞结构知,每个晶胞中含有![]() 个
个![]() 和
和![]() 个
个![]() ,则
,则![]() 晶体的密度可表示为
晶体的密度可表示为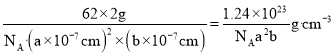 。
。


科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
回答下列问题:
(1).上述反应中属于放热反应的是________。
(2).H2的燃烧热![]() ________________;C的燃烧热
________________;C的燃烧热![]() ________________。
________________。
(3).燃烧![]() 生成液态水,放出的热量为________。
生成液态水,放出的热量为________。
(4).写出CO燃烧的热化学方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,![]() 某一元酸HA在水中有
某一元酸HA在水中有![]() 发生电离,下列叙述不正确的是
发生电离,下列叙述不正确的是![]()
①该溶液的![]() ;
;
②升高温度,溶液的pH增大;
③此酸的电离平衡常数约为![]() ;
;
④加水稀释后,各离子的浓度均减小;
⑤由HA电离出的![]() 约为水电离出的
约为水电离出的![]() 的
的![]() 倍;
倍;
⑥适当增大HA的浓度,HA的电离平衡正向移动,电离平衡常数增大。
A.②④⑥B.①④⑤C.②⑤⑥D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通入乙烷和氧气,其电极反应式为:C2H6+18OH- –14e-→2CO![]() +12H2O、7H2O+7/2O2+14e-→14OH-,有关此电池的推断正确的是( )
+12H2O、7H2O+7/2O2+14e-→14OH-,有关此电池的推断正确的是( )
A.通氧气的电极为负极
B.参加反应的氧气与C2H6的物质的量之比为7∶2
C.放电一段时间后,KOH的物质的量浓度不变
D.电解质溶液中,CO![]() 向正极移动
向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中能大量共存的是( )
A.pH =1的溶液中:NH4+、SO42-、ClO-、Na+
B. 的溶液中:Na+、K+、MnO4-、HCO3-
的溶液中:Na+、K+、MnO4-、HCO3-
C.0.1molL-1的Na2SO3溶液中:H+、K+、SO42-、NO3-
D.澄清透明的溶液中:Fe3+、Na+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗在自然界中非常分散,几乎没有比较集中的锗矿,因此被人们称为“稀散金属”。回答下列问题:
(1)基态锗原子最外层电子排布图为_______,Ge原子的电子发生跃迁时会吸收或放出不同的光,可用_______![]() 填仪器名称
填仪器名称![]() 摄取其原子光谱,从而鉴定Ge元素的存在。
摄取其原子光谱,从而鉴定Ge元素的存在。
(2)锗元素能形成无机化合物![]() 如锗酸钠:
如锗酸钠:![]() ;二锗酸钠:
;二锗酸钠:![]() ;四锗酸钠:
;四锗酸钠:![]() 等
等![]() ,也能形成类似于烷烃的锗烷
,也能形成类似于烷烃的锗烷![]() 。
。
![]() 中锗原子的杂化方式为______________。
中锗原子的杂化方式为______________。
![]() 锗与碳同族,性质及结构有一定的相似性,据此推测
锗与碳同族,性质及结构有一定的相似性,据此推测![]() 二锗酸钠
二锗酸钠![]() 中含有的
中含有的![]() 键的数目为_________。
键的数目为_________。
![]() 至今没有发现n大于5的锗烷,根据下表提供的数据分析其中的原因:___________________。
至今没有发现n大于5的锗烷,根据下表提供的数据分析其中的原因:___________________。
化学键 |
|
|
|
|
键能 | 346 | 411 | 188 | 288 |
(3)有机多元膦酸锗配合物是由![]() Ⅳ
Ⅳ![]() 与
与![]() 形成的,其结构如下:
形成的,其结构如下:
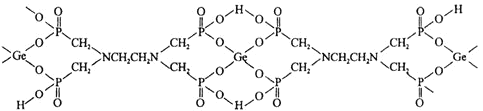
![]() 该配合物中,下列作用力不存在的有_________
该配合物中,下列作用力不存在的有_________
A.极性键 ![]() 非极性键
非极性键 ![]() 金属键
金属键 ![]() 配位键
配位键 ![]() 氢键
氢键 ![]() 键
键
![]() 该配合物中
该配合物中![]() Ⅳ
Ⅳ![]() 的配位数是_______;配位原子是_______
的配位数是_______;配位原子是_______![]() 填元素符号
填元素符号![]() 。
。
![]() 试解释磷酸
试解释磷酸![]() 酸性为什么与亚硝酸相近?______________。
酸性为什么与亚硝酸相近?______________。
(4)![]() 常作为军事上的红外制导材料,其理想晶胞如图所示。测得晶胞参数
常作为军事上的红外制导材料,其理想晶胞如图所示。测得晶胞参数![]() ,
,![]() ,该晶体的密度为_______
,该晶体的密度为_______![]() 列出算式即可,阿伏加德罗常数用
列出算式即可,阿伏加德罗常数用![]() 表示
表示![]() 。
。

![]() 原子的分数坐标即将晶胞参数a、b、c均看作“1”所得出的三维空间坐标,以1号Zn为坐标原点,则
原子的分数坐标即将晶胞参数a、b、c均看作“1”所得出的三维空间坐标,以1号Zn为坐标原点,则![]() 晶胞图中标号为“2”的P原子的分数坐标为_______。
晶胞图中标号为“2”的P原子的分数坐标为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断哪些违反了泡利原理________,哪些违反了洪特规则________。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(2)![]() 可用于制造火柴,其分子结构如图所示。
可用于制造火柴,其分子结构如图所示。

![]() 分子中硫原子的杂化轨道类型为________。
分子中硫原子的杂化轨道类型为________。
![]() 每个
每个![]() 分子中含有的孤电子对的数目为________。
分子中含有的孤电子对的数目为________。
(3)科学家合成了一种阳离子“![]() ”,其结构是对称的,5个N排成“V”形,每个N都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“
”,其结构是对称的,5个N排成“V”形,每个N都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“![]() ”的化学式为“
”的化学式为“![]() ”的离子晶体,其电子式为________。分子
”的离子晶体,其电子式为________。分子![]() 中键与键之间的夹角为
中键与键之间的夹角为![]() ,并有对称性,分子中每个原子的最外层均满足8电子稳定结构,其结构式为________________。
,并有对称性,分子中每个原子的最外层均满足8电子稳定结构,其结构式为________________。
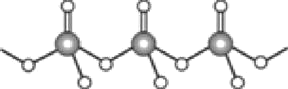
(4)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为________。
(5)碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和金属阳离子半径
碳酸盐 |
|
|
|
|
热分解温度 | 402 | 900 | 1172 | 1360 |
金属阳离子半径 | 66 | 99 | 112 | 135 |
随着金属阳离子半径的增大,碳酸盐的热分解温度逐步升高,原因是_____________。
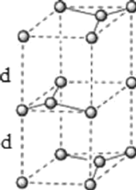
(6)石墨的晶体结构和晶胞结构如图所示。已知石墨的密度为![]() ,
,![]() 键的键长为
键的键长为![]() ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为![]() ,则石墨晶体的层间距为________cm。
,则石墨晶体的层间距为________cm。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH―= FeO42―+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色FeO42―,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。回答下列问题:

(1)铁作________极,电极反应式为___________________________________________________。
(2)每制得1mol Na2FeO4,理论上可以产生标准状况 ____________ L 气体。
(3)电解一段时间后,c(OH―)降低的区域在_______________________(填“阴极室”或“阳极室”)。
(4)电解过程中,须将阴极产生的气体及时排出,其原因为_____________________。
(5)c(Na2FeO4)随初始c(NaOH)的变化如图2,分析M点c(Na2FeO4)低于最高值的原因_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将![]() 转变为
转变为![]() 的方法为( )
的方法为( )
A.与足量的NaOH溶液共热后,再通入CO2
B.溶液加热,通入足量的HCl
C.与稀H2SO4共热后,加入足量的Na2CO3
D.与稀H2SO4共热后,加入足量的NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com