
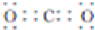 ��
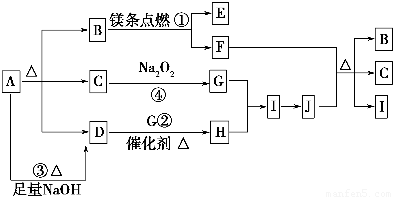
������ A�����ֽܷ⣬�ֽ�õ������ʵ�����B��C��D����A��Ӧ����D����AΪ��ʽ�λ���Σ�C�ܺ������Ʒ�Ӧ����CΪˮ�������̼��þ������B��ȼ�գ���BΪ������̼����������ΪA���ȷֽ�����B��C��D����BΪ������̼��CΪˮ��ˮ�������Ʒ�Ӧ����NaOH��O2��D���ڴ��������·�Ӧ����H����D��NH3��G��O2��H��NO��I��NO2��J��HNO3��þ�Ͷ�����̼��Ӧ��������þ��̼��C��Ũ���ᷴӦ���ɶ�����̼������������ˮ����E��MgO��F��C��ͨ�����Ϸ���֪��AΪNH4HCO3���Դ˽����⣮
��� �⣺A�����ֽܷ⣬�ֽ�õ������ʵ�����B��C��D����A��Ӧ����D����AΪ��ʽ�λ���Σ�C�ܺ������Ʒ�Ӧ����CΪˮ�������̼��þ������B��ȼ�գ���BΪ������̼����������ΪA���ȷֽ�����B��C��D����BΪ������̼��CΪˮ��ˮ�������Ʒ�Ӧ����NaOH��O2��D���ڴ��������·�Ӧ����H����D��NH3��G��O2��H��NO��I��NO2��J��HNO3��þ�Ͷ�����̼��Ӧ��������þ��̼��C��Ũ���ᷴӦ���ɶ�����̼������������ˮ����E��MgO��F��C��ͨ�����Ϸ���֪��AΪNH4HCO3��
��1��F��C�����ɵ���F��Ԫ�������ڱ���λ���ǵڶ����ڵڢ�A�壬BΪ������̼��B�ĵ���ʽΪ ��
��
�ʴ�Ϊ���ڶ����ڵڢ�A�壻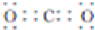 ��
��
��2����Ӧ�ٵĻ�ѧ����ʽΪ2Mg+CO2$\frac{\underline{\;��ȼ\;}}{\;}$2MgO+C����Ӧ��Ϊ�ڴ��������������£���������������һ��������ˮ����Ӧ����ʽΪ��4NH3+5O2$\frac{\underline{����}}{��}$4NO+6H2O��
�ʴ�Ϊ��2Mg+CO2$\frac{\underline{\;��ȼ\;}}{\;}$2MgO+C��4NH3+5O2$\frac{\underline{����}}{��}$4NO+6H2O��
��3����Ӧ��Ϊ�ڼ��������£�̼����狀��������Ʒ�Ӧ�����ӷ���ʽΪNH4++HCO3-+2OH- $\frac{\underline{\;\;��\;\;}}{\;}$NH3��+CO32-+2H2O��
�ʴ�Ϊ��NH4++HCO3-+2OH- $\frac{\underline{\;\;��\;\;}}{\;}$NH3��+CO32-+2H2O��
��4��H��NO����һ�������£�2L��H������0.5L���������ϣ����û�����屻������NaOH��Һ��ȫ���պ�û��������������ݵ��ӵ�ʧ�غ��֪�������ɵĵ�Ԫ�صĺ������εĻ�ѧʽ��NaNO3��
�ʴ�Ϊ��NaNO3��
���� ���⿼��������ת����ϵ���������ʵ�Ӧ�ã������漰�����仯���Al��HNO3��H2SO4�����ʵ�����Ӧ�����ݣ��ۺϿ��鿼����������Ԫ�ػ�����֪ʶ����������������Ŀ�Ѷ��еȣ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������A��ʾ�ķ�Ӧ��ƽ������Ϊ0.6 mol•��L•s��-1 | |
| B�� | 2 sʱ����B��Ũ��Ϊ1.4 mol•L-1 | |
| C�� | 2 sʱ����A��ת����Ϊ70% | |
| D�� | 2 sʱ����A���������Ϊ$\frac{14}{27}$ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��
��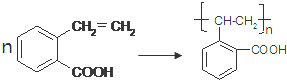 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ȳ��ǵ����Ҳ���Ƿǵ���� | |
| B�� | ����ȼ�յIJ���ɵ������� | |
| C�� | ���������ȼ�ϵ�ص�ȼ�� | |
| D�� | �������IJ�ͬ������ȫȼ�գ�����ĺ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
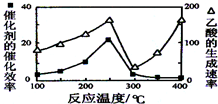 CH4��CO2���������ֵ���ߵĻ�ѧ��Ʒ����֪��
CH4��CO2���������ֵ���ߵĻ�ѧ��Ʒ����֪���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
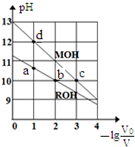 �����£��������ΪV0��Ũ�Ⱦ�Ϊc mol•L-1��MOH��ROH��Һ�зֱ��ˮϡ�������ΪV����ҺpH��-1g$\frac{{V}_{0}}{V}$�ı仯��ͼ��ʾ������������ȷ���ǣ�������
�����£��������ΪV0��Ũ�Ⱦ�Ϊc mol•L-1��MOH��ROH��Һ�зֱ��ˮϡ�������ΪV����ҺpH��-1g$\frac{{V}_{0}}{V}$�ı仯��ͼ��ʾ������������ȷ���ǣ�������| A�� | ���ԣ�MOH��ROH | |
| B�� | b��c�������Һ�У�c��R+����c��M+�� | |
| C�� | ��Һ��ˮ�ĵ���̶Ȧ�����c����b����a����d | |
| D�� | c��0.1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ǽ����ԣ�Cl��I | B�� | ���ԣ�KOH��NaOH | ||
| C�� | ���ԣ�H2SO3��H2SO4 | D�� | ���H+������CO32-��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
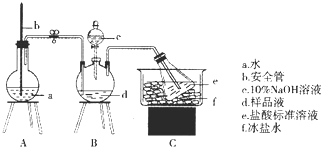
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� HCl��H2SO3 | B�� | ������ Mg��Al | C�� | ���� NaOH��Mg��OH��2 | D�� | �ȶ��� HF��HCl |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com