
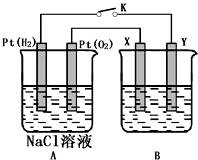
 某化学兴趣小组用如图所示装置进行电化学原理的实验探究,试回答下列问题:
某化学兴趣小组用如图所示装置进行电化学原理的实验探究,试回答下列问题:分析 (1)左边是燃料电池,右边是电解池,通氧气的一极是正极发生还原反应,电极反应式为:O2+4e-+2H2O=4OH-;
(2)X与电源的正极相连,是阳极发生氧化反应,电解质溶液是硝酸银溶液;
(3)粗铜中含有Zn、Fe、Ag、Au等杂质,其中锌和铁会在电极上放电生成阳离子进入溶液,所以阳极泥的主要成分是Ag、Au;
(4)X电极是阳极发生氧化反应,电极反应式为:2Cu+2OH--2e-=Cu2O+H2O.
解答 解:(1)A池是燃料电池,B池是电解池,通氧气的一极是正极发生还原反应,电极反应式为:O2+4e-+2H2O=4OH-,
故答案为:正;O2+4e-+2H2O=4OH-;
(2)X与电源的正极相连,是阳极发生氧化反应,所以X电极材料为银,电解质溶液是硝酸银溶液,
故答案为:Ag;AgNO3溶液;
(3)粗铜中含有Zn、Fe、Ag、Au等杂质,其中锌和铁会在电极上放电生成阳离子进入溶液,所以阳极泥的主要成分是Ag、Au,
故答案为:Ag、Au;
(4)X电极是阳极发生氧化反应,电极反应式为:2Cu+2OH--2e-=Cu2O+H2O,
故答案为:2Cu+2OH--2e-=Cu2O+H2O.
点评 本题考查原电池、电解池工作原理,题目难度中等,正确推断燃料电池正负极是解本题的关键,注意掌握原电池、电解池工作原理,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 一个该气体分子的质量为M/NA | |
| B. | 一个该气体分子的体积为Vm/NA | |
| C. | 气体摩尔体积的大小取决于气体分子本身的大小 | |
| D. | 上述说法均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都正确 | B. | ②③④⑤ | C. | ②⑤⑥ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C>D>B>A | B. | D>B>A>C | C. | A>D>C>B | D. | B>A>C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在空气中燃烧的生成物都是过氧化物 | |
| B. | 与水反应的剧烈程度随核电荷数增加而增强 | |
| C. | 最高价氧化物对应水化物的碱性随核电荷数增加而增强 | |
| D. | 还原性随原子电子层数的增加而增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤和石油都是混合物,都只由碳和氢两种元素组成 | |
| B. | 煤的气化和液化都是物理变化 | |
| C. | 煤的干馏和石油的分馏发生的都是化学变化 | |
| D. | 用溴的四氯化碳溶液可鉴别直馏汽油和裂化汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发掉0.5L水 | B. | 标况下通入44.8L HCl气体 | ||
| C. | 将溶液加热蒸发浓缩至0.5L | D. | 加入6mol/L盐酸1L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com