
| A. | 含1molFeCl3的饱和溶液最多可形成胶体粒子数为NA | |
| B. | 4.6gNa与稀盐酸反应,转移电子数一定为0.2NA | |
| C. | 10.6gNa2CO3晶体中含CO32-数目为0.1NA | |
| D. | 常温下,22gCO2含碳氧双键数目为NA |
分析 A、一个氢氧化铁胶粒是多个氢氧化铁分子的聚集体;
B、求出钠的物质的量,然后根据反应后钠元素变为+1价来分析;
C、求出碳酸钠的物质的量,然后根据1mol碳酸钠中含1molCO32-来分析;
D、求出二氧化碳的物质的量,然后根据1mol二氧化碳中含2条碳氧双键来分析.
解答 解:A、一个氢氧化铁胶粒是多个氢氧化铁分子的聚集体,故1mol氯化铁所形成的胶粒个数小于NA个,故A错误;
B、4.6g钠的物质的量为0.2mol,与盐酸反应时,即使盐酸不足,钠还能与水反应,而反应后钠元素变为+1价,故0.2mol钠一定失去0.2mol电子,故B正确;
C、10.6g碳酸钠的物质的量为0.1mol,而1mol碳酸钠中含1molCO32-,故0.1mol碳酸钠中含0.1mol碳酸根即0.1NA个,故C正确;
D、22g二氧化碳的物质的量为0.5mol,而1mol二氧化碳中含2条碳氧双键,故0.5mol二氧化碳中含1mol碳氧双键即NA个,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯:CH3COOCH3CH2 | B. | 硝基苯: | ||
| C. | 丙烯:CH2CHCH3 | D. | 二甲醚:CH3OCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纯碱中常含有少量的NaCl等杂质,下图仪器装置可用来测定纯碱中Na2CO3的质量分数.图中:①空气 ②某溶液 ③纯碱 ④某溶液 ⑤碱石灰
纯碱中常含有少量的NaCl等杂质,下图仪器装置可用来测定纯碱中Na2CO3的质量分数.图中:①空气 ②某溶液 ③纯碱 ④某溶液 ⑤碱石灰 ;装置C的作用是吸收生成的二氧化碳气体中的水蒸气;如果撤去装置C,则会导致测定结果偏高(填“偏大”、“偏小”或“不变”)
;装置C的作用是吸收生成的二氧化碳气体中的水蒸气;如果撤去装置C,则会导致测定结果偏高(填“偏大”、“偏小”或“不变”)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去).已知A、B为气态单质,F是地壳中含量最多的金属元素的单质,E、H、I为氧化物,E为黑色固体,I为红棕色气体,M为红褐色沉淀.
下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去).已知A、B为气态单质,F是地壳中含量最多的金属元素的单质,E、H、I为氧化物,E为黑色固体,I为红棕色气体,M为红褐色沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
. (已知:该反应条件为细菌,产生等物质的量的两种气体).
(已知:该反应条件为细菌,产生等物质的量的两种气体).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
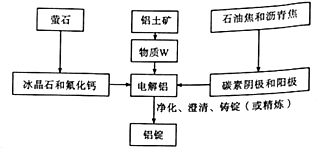 材料是人类赖以生存和发展的重要物质基础.回答下一问题:
材料是人类赖以生存和发展的重要物质基础.回答下一问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定条件下,固定容积的密闭容器中反应:2NO2(g)?O2(g)+2NO(g);(△H>0),达平衡.改变其中一个条件X,Y随X变化符合曲线的是( )
在一定条件下,固定容积的密闭容器中反应:2NO2(g)?O2(g)+2NO(g);(△H>0),达平衡.改变其中一个条件X,Y随X变化符合曲线的是( )| A. | 当X表示温度时,Y表示NO2的物质的量 | |
| B. | 当X表示温度时,Y表示NO2的转化率 | |
| C. | 当X表示反应时间时,Y表示混合气体的密度 | |
| D. | 当X表示NO2的物质的量时,Y表示O2的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A<B<C | |
| B. | B与A的化合物比A与C 的化合物熔点低 | |
| C. | 氢化物稳定性:A<C | |
| D. | A与C的化合物属于大气污染物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com