
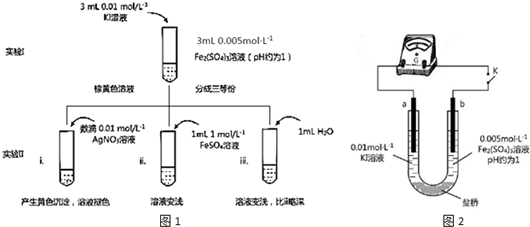
分析 (1)待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到化学平衡状态;
(2)根据实验iii和实验ii的对比可以看出是为了排除有ii中水造成溶液中离子浓度改变的影响;
(3)i.加入AgNO3,Ag+与I-生成AgI黄色沉淀,I-浓度降低,2Fe3++2I-?2Fe2++I2平衡逆向移动;
ii.加入FeSO4,Fe2+浓度增大,平衡逆移;
①K闭合时,指针向右偏转,可知b极Fe3+得到电子,作正极;
②当指针归零(反应达到平衡)后,向U型管左管中滴加0.01mol/L AgNO3溶液,若生成黄色沉淀,可知I-浓度降低,2Fe3++2I-?2Fe2++I2平衡逆向移动;
(5)①Fe2+浓度增大,还原性增强;
②与(4)实验对比,不同的操作是当指针归零(反应达到平衡)后,向U型管右管中滴加0.01mol/L FeSO4溶液;
(6)将(3)和(4)、(5)作对比,可知氧化性、还原性与浓度有关.
解答 解:(1)待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到化学平衡状态,故答案为:化学平衡状态;
(2)根据实验iii和实验ii的对比可以看出是为了排除有ii中水造成溶液中离子浓度改变的影响,故答案为:溶液稀释对颜色变化的影响;
(3)i.加入AgNO3,Ag+与I-生成AgI黄色沉淀,I-浓度降低,2Fe3++2I- 2Fe2++I2平衡逆向移动,
2Fe2++I2平衡逆向移动,
ii.加入FeSO4,Fe2+浓度增大,平衡逆移,
故答案为:加入Ag+发生反应:Ag++I-=AgI↓,c(I-)降低;或c(Fe2+)增大,平衡均逆向移动;
(4)①K闭合时,指针向右偏转,b极为Fe3+得电子,作正极,故答案为:正;
②当指针归零(反应达到平衡)后,向U型管左管滴加0.01mol/L AgNO3溶液,产生黄色沉淀,I-离子浓度减小,2Fe3++2I- 2Fe2++I平衡左移,指针向左偏转,故答案为:左管产生黄色沉淀,指针向左偏转;
2Fe2++I平衡左移,指针向左偏转,故答案为:左管产生黄色沉淀,指针向左偏转;
(5)①Fe2+向Fe3+转化的原因是Fe2+浓度增大,还原性增强,故答案为:Fe2+随浓度增大,还原性增强,使Fe2+还原性强于I-;
②与(4)实验对比,不同的操作是当指针归零后,向U型管右管中滴加1mol/L FeSO4溶液,故答案为:向U型管右管中滴加1mol•L-1 FeSO4溶液;
(6)将(3)和(4)、(5)作对比,得出的结论是在其它条件不变时,物质的氧化性和还原性与浓度有关,浓度的改变可影响物质的氧化还原性,导致平衡移动,故答案为:该反应为可逆氧化还原反应,在平衡时,通过改变物质的浓度,可以改变物质的氧化、还原能力,并影响平衡移动方向.
点评 本题为2015年北京高考真题,侧重原电池、氧化还原反应及平衡移动的综合考查,把握平衡移动的影响因素及物质的性质为解答的关键,对分析与实验能力要求较高,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | V(D)=0.40 mol•L-1•s-1 | B. | V (C)=0.50 mol•L-1•s-1 | ||
| C. | V(B)=1.2 mol•L-1•min-1 | D. | V(A)=0.30 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
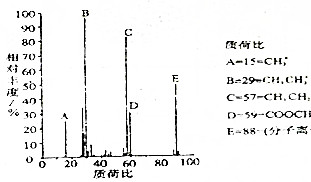 某有机物A的最简式为C2H4O,其质谱图如图所示:有机物A的质谱图和主要碎片的归属
某有机物A的最简式为C2H4O,其质谱图如图所示:有机物A的质谱图和主要碎片的归属查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 5种 | C. | 6种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ | |
| C. | 反应至4min时,若HCl的浓度为0.12mol•L-1,则H2的反应速率为:0.015mol/(L•min) | |
| D. | 当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol•L-1的NaOH溶液恰好反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
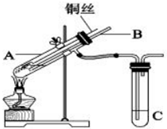 (1)用铜与浓硫酸反应制取硫酸铜,实验装置如图所示.
(1)用铜与浓硫酸反应制取硫酸铜,实验装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向逆反应方向移动 | B. | x+y<z | ||
| C. | C的体积分数降低 | D. | B的转化率降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
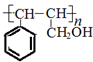 .
.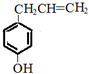 .
.
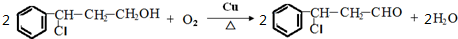 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com