
①称取样品0.
②向A中加入过量KI固体,振荡,盐酸酸化后置于暗处,发生反应:
Com++I-![]() Co2++I2(未配平)
Co2++I2(未配平)
反应完成后,蒸馏水稀释,用Na2S2O3溶液滴定析出的I2,消耗0.1000mol·L-1Na2S2O3溶液20.00mL。反应方程式为:I2+2Na2S2O3====2NaI+Na2S4O6
③另称取该物质样品0.
[Co(NH3)xCly]Clz+zAgNO3====[Co(NH3)xCly](NO3)z+zAgCl↓
通过计算求:
(1)写出用氢氧化钠溶液滴定溶液B时的离子方程式。
(2)[Co(NH3)xCly]Clz中氮元素的质量分数。
(3)请写出该钴化合物的化学式,写出[Co(NH3)xCly]Clz溶于水时的电离方程式。
(1)OH-+H+=H2O
(2)27.94%
(3)[Co(NH3)5Cl]Cl2
[Co(NH3)5Cl] Cl2=[Co(NH3)5Cl]2++2Cl-
提示:氢氧化钠溶液滴定溶液B时,溶液中过量的盐酸跟氢氧化钠反应,其中的氯化铵没有跟氢氧化钠溶液反应。
根据①可计算出0.
0.
n(NH3)=0.05×0.5000-0.04×0.1000×![]() =0.00500mol
=0.00500mol
A溶液中跟碘化钾反应生成I2的物质的量为
0.1000×0.02×![]() =0.001mol
=0.001mol
0.
涉及到酸碱中和、氧化还原反应、元素化合价、配合物等基础知识。主要考查分析和综合能力,测试对元素化合物知识的掌握水平和化学计算基本技能,难度较大,属于拉分题。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)氮元素基态原子核外未成对电子数为
(1)氮元素基态原子核外未成对电子数为查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | 溶度积(室温时)Ksp | 沉淀完全时的pH | 氯化钴晶体的性质 |
| Co(OH)2 | 5.9×10-15 | 9.4 | CoCl2?6H2O呈红色,常温下稳定.110°C~120°C时脱水变成蓝色无水氯化钴 |
| Fe(OH)2 | 1.6×10-14 | 9.6 | |
| Fe(OH)3 | 1.0×10-35 | x |
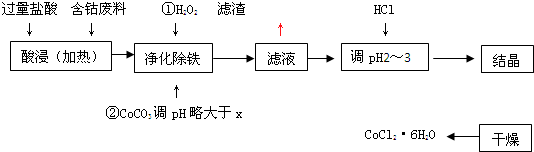
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com