
 .
. .
. 分析 化合物A(C4H10O)可与金属钠反应,说明有羟基,A与氯气在光照条件下反应只得到一种一氯取代物,说明A的结构是一种对称结构,则A为 ,化合物B(C6H6O2)分子内有两种不同化学环境的H原子,则B为
,化合物B(C6H6O2)分子内有两种不同化学环境的H原子,则B为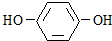 ,A与B分子间脱水得到化合物C,C与氢氧化钠溶液作用得到化合物D(C10H12O2Na2),则C为
,A与B分子间脱水得到化合物C,C与氢氧化钠溶液作用得到化合物D(C10H12O2Na2),则C为 ,D为
,D为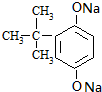 ,据此答题.
,据此答题.
解答 解:化合物A(C4H10O)可与金属钠反应,说明有羟基,A与氯气在光照条件下反应只得到一种一氯取代物,说明A的结构是一种对称结构,则A为 ,化合物B(C6H6O2)分子内有两种不同化学环境的H原子,则B为
,化合物B(C6H6O2)分子内有两种不同化学环境的H原子,则B为 ,A与B分子间脱水得到化合物C,C与氢氧化钠溶液作用得到化合物D(C10H12O2Na2),则C为
,A与B分子间脱水得到化合物C,C与氢氧化钠溶液作用得到化合物D(C10H12O2Na2),则C为 ,D为
,D为 ,
,
(1)根据上面的分析可知,化合物A的结构简式是 ,
,
故答案为: ;
;
(2)根据上面的分析可知,C的结构简式为 ,
,
故答案为: .
.
点评 本题考查了有机物的推断,涉及官能团性质、有机反应等,解题关键是根据A的性质及与氯气反应后的结构特点确定A的结构,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 卤素都是活泼的金属元素 | |
| B. | 卤素是常见的成盐元素,都是氧化剂 | |
| C. | 卤素原子最外层都有7个电子 | |
| D. | 卤化氢、卤化银的性质都有相似之处 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温、常压下,11.2L N2含有的分子数为0.5NA | |
| B. | 标准状况下,18g H2O的体积是22.4L | |
| C. | NA个SO2的体积是22.4L | |
| D. | 标准状况下,22.4L H2 与O2的混合气体所含原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
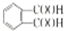 .
.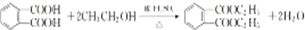 .
.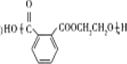 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎把浓硫酸沾在手上,立即用干布拭去,再用水冲洗 | |
| B. | 不慎把苯酚沾在手上,立即用70℃以上的热水冲洗 | |
| C. | 金属钠着火,用泡沫灭火器扑灭 | |
| D. | 酒精灯不慎碰翻着火,用湿布盖灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知H2C2O4为二元中强酸.某化学兴趣小组为测定含Na2SO4、NaHC2O4和H2C2O4•2H2O的试样中各物质的质量分数,进行了如下实验:
已知H2C2O4为二元中强酸.某化学兴趣小组为测定含Na2SO4、NaHC2O4和H2C2O4•2H2O的试样中各物质的质量分数,进行了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com