
分析 (1)根据相同温度下,同一可逆反应的正逆平衡常数互为倒数关系,同一可逆反应平衡常数与系数成幂次方关系计算;
(2)根据浓度熵和平衡常数之间的关系来判断反应的状态;
解答 解:(1)反应2NH3(g)?N2(g)+3H2(g)和反应N2(g)+3H2(g)?2NH3(g)是互为可逆反应,平衡常数互为倒数,又已知在450℃时,N2 (g)+3H2(g)?2NH3(g)△H<0的平衡常数K=0.25,所以2NH3(g)?N2(g)+3H2(g)反应的平衡常数是$\frac{1}{0.25}$=4,又平衡常数与系数成幂次方关系,所以NH3(g)?$\frac{1}{2}$N2 (g)+$\frac{3}{2}$H2(g)的平衡常数K=$\sqrt{4}$=2,故答案为:2;
(2)一段时间后,当N2、H2、NH3的物质的量浓度分别为$\frac{1mol}{0.5L}$=2mol/L、$\frac{1mol}{0.5L}$=2mol/L、$\frac{2mol}{0.5L}$=4mol/L时,Qc=$\frac{{4}^{2}}{2×2{\;}^{3}}$=1>K,所以此时为向逆反应方向移动,则此时反应V(N2)正<V(N2)逆,故答案为:<;
点评 本题考查化学平衡常数的计算等问题,侧重于利用平衡常数对化学平衡移动方向的判断,题目难度不大,注意把握平衡常数的意义.


科目:高中化学 来源: 题型:多选题
| A. | 同主族元素从上到下,元素原子得电子能力逐渐减弱,表现在氢化物的稳定性逐渐增强 | |
| B. | 除稀有气体元素外,第三周期元素的原子半径不一定比第二周期元素的原子半径大 | |
| C. | 化学反应的过程中一定伴随着热量的变化 | |
| D. | 在主族元素中,最外层电子数少的元素原于一定比最外层电子数多的元素原子失电子能力强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该有机物分子中C、H、O原子个数比为1:4:1 | |
| B. | 该有机物分子中C、H原子个数比为1:4 | |
| C. | 该有机物中必定含有氧元素 | |
| D. | 该有机物化学式为CH4O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸和水 | B. | 熟石灰和水 | C. | 生石灰和水 | D. | 氯化钠和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 1 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
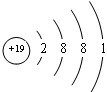 .
.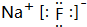 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LSO3所含电子数约为40NA | |
| B. | 0.5molNH4HSO4晶体中,含有H+数目约为0.5NA | |
| C. | 48gO2,O3混合气体含有的氧原子数为3NA | |
| D. | 1molCl2作为氧化剂得到的电子数一定为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com