
| A. | ①②③④ | B. | ②③④⑤ | C. | ②③④ | D. | ②③⑤ |
分析 ①电解质是指在水溶液里或熔化状态下能够导电的化合物,非电解质是指在水溶液里和熔化状态下都不能够导电的化合物;
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应;
③有离子参加的反应为离子反应,否则为非离子反应;
④由一种元素组成的纯净物是单质,由两种或两种以上元素构成的纯净物是化合物;
⑤根据分散质粒子直径的大小,分散系分为溶液、胶体和浊液;
解答 解:①水溶液中或熔融状态导电的化合物为电解质,水溶液中和熔融状态不能导电的化合物为非电解质,故①错误;
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应,有电子转移的是氧化还原反应,无电子转移的是非氧化还原反应,故②正确;
③有离子参加的反应为离子反应,否则为非离子反应,故③正确.
④由一种元素组成的纯净物是单质,由两种或两种以上元素构成的纯净物是化合物,故单质和化合物的区别是纯净物中元素的种类,故④正确;
⑤根据分散质粒子直径的大小,分散系分为溶液、胶体和浊液,故⑤错误;
故选:C.
点评 本题考查了氧化物、化学反应、分散系和电解质的分类依据,掌握分类标准是解题关键,难度不大.


科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C+H2O=CO+H2;△H=+131.2KJ/mol | |
| B. | CO(g)+H2(g)=C(s)+H2O(g);△H=-131.2KJ/mol | |
| C. | C(s)+H2O(g)=CO(g)+H2(g);△H=+10.93KJ/mol | |
| D. | C(s)+H2O(g)=CO(g)+H2(g);△H=-131.2KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
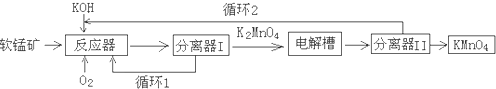
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
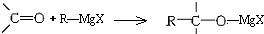 ,所得产物经水解可以得到醇,这是某些复杂醇的合成方法之一.现欲合成(CH3)3C-OH,下列所选用的卤代烃和羰基化合物的组合正确的是( )
,所得产物经水解可以得到醇,这是某些复杂醇的合成方法之一.现欲合成(CH3)3C-OH,下列所选用的卤代烃和羰基化合物的组合正确的是( )| A. | 乙醛和氯乙烷 | B. | 甲醛和1-溴丙烷 | C. | 甲醛和2-溴丙烷 | D. | 丙酮和一氯甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

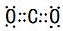 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
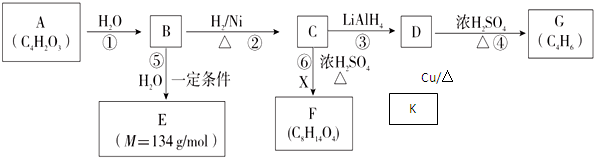
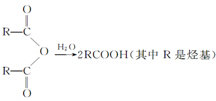 ②R-COOH$\stackrel{LiAlH_{4}}{→}$R-CH2OH(其中R是烃基)
②R-COOH$\stackrel{LiAlH_{4}}{→}$R-CH2OH(其中R是烃基)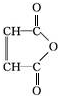 ;B中含氧官能团的名称是羧基;
;B中含氧官能团的名称是羧基;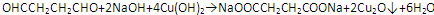
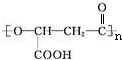 .有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有2 种.
.有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有2 种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
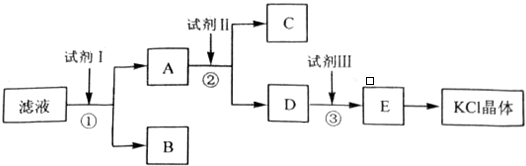
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com