·ÖĪö£ŗAÕōĘų¶ŌĒāĘųµÄĻą¶ŌĆܶČĪŖ37£¬¹ŹAµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ37”Į2=74£¬7.4gÓŠ»śĪļAµÄĪļÖŹµÄĮæĪŖ
=0.1mol£¬ĶźČ«Č¼ÉÕæɲśÉś0.4molCO
2ŗĶ0.5mol H
2O£¬¹Ź·Ö×ÓÖŠCŌ×ÓŹżÄæĪŖ
=4£¬HŌŖĖŲŹżÄæĪŖ
=10£¬OŌ×ÓŹżÄæĪŖ
=1£¬¹ŹAµÄ·Ö×ÓŹ½ĪŖC
4H
10O£¬øł¾ŻB×Ŗ»ÆCµÄ·“Ó¦æÉÖŖ£¬Bŗ¬ÓŠC=OĖ«¼ü£¬¹ŹAÖŠŗ¬ÓŠ-OH£¬ŗĖ“Ź²ÕńĒāĘ×ĻŌŹ¾AÖŠÓŠ5ÖÖĄąŠĶĒāŌ×ÓµÄĪüŹÕ·å£¬·åĆ껿֮±ČĪŖ3£ŗ3£ŗ2£ŗ1£ŗ1£¬¹ŹAĪŖ

£¬Óė±½¼×Ėį·¢Éśõ„»Æ·“Ӧɜ³ÉĻćĮĻX£¬¹ŹXĪŖ

£®A·¢ÉśŃõ»Æ·“Ӧɜ³ÉB£¬BĪŖ
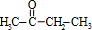
£¬ÓÉ·“Ó¦ŠÅĻ¢æÉÖŖ£¬
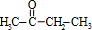
ÓėCH
3CH
2CH
2CH
2MgCl·¢Éś¼Ó³É·“Ӧɜ³ÉC£¬CŌŁĖ®½āÉś³ÉD£¬¹ŹDĪŖCH
3C£ØOH£©£ØC
2H
5£©CH
2CH
2CH
2CH
3£¬D·¢ÉśĻūČ„·“Ӧɜ³ÉE£Ø3-¼×»ł-3-øżĻ©£©£¬E½į¹¹¼ņŹ½ĪŖCH
3CH
2C£ØCH
3£©=CHCH
2CH
2CH
3£®ĒżĪĆ“¼µÄĆū³ĘĪŖ2-ŅŅ»ł-1£¬3-¼ŗ¶ž“¼£¬½į¹¹¼ņŹ½ĪŖHOCH
2CH£ØC
2H
5£©CH£ØOH£©CH
2CH
2CH
3£¬½įŗĻEÓėĒżĪĆ“¼µÄ½į¹¹”¢FµÄ·Ö×ÓŹ½æÉÖŖ£¬EŌŚøßĪĀ»ņ¹āÕÕĢõ¼žĻĀ£¬C=CÖŠ¼×»łÉĻHŌ×Ó±»BrŌ×ÓČ”“ś£¬¹ŹFĪŖCH
3CH
2C£ØCH
2Br£©=CHCH
2CH
2CH
3£¬FŌŚĒāŃõ»ÆÄĘĖ®ČÜŅŗ”¢¼ÓČČĢõ¼žĻĀ·¢ÉśĖ®½ā·“Ӧɜ³ÉG£¬GµÄ½į¹¹¼ņŹ½ĪŖCH
3CH
2C£ØCH
2OH£©=CHCH
2CH
2CH
3£¬G·¢Éś¼Ó³É·“Ӧɜ³ÉK£¬KĪŖCH
3CH
2C£ØCH
2Br£©CH£ØBr£©CH
2CH
2CH
3£¬KĒāŃõ»ÆÄĘĖ®ČÜŅŗ”¢¼ÓČČĢõ¼žĻĀ·¢ÉśĖ®½ā·“Ӧɜ³ÉĒżĪĆ“¼£¬¾Ż“Ė½ā“š£®
½ā“š£ŗAÕōĘų¶ŌĒāĘųµÄĻą¶ŌĆܶČĪŖ37£¬¹ŹAµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ37”Į2=74£¬7.4gÓŠ»śĪļAµÄĪļÖŹµÄĮæĪŖ
=0.1mol£¬ĶźČ«Č¼ÉÕæɲśÉś0.4molCO
2ŗĶ0.5mol H
2O£¬¹Ź·Ö×ÓÖŠCŌ×ÓŹżÄæĪŖ
=4£¬HŌŖĖŲŹżÄæĪŖ
=10£¬OŌ×ÓŹżÄæĪŖ
=1£¬¹ŹAµÄ·Ö×ÓŹ½ĪŖC
4H
10O£¬øł¾ŻB×Ŗ»ÆCµÄ·“Ó¦æÉÖŖ£¬Bŗ¬ÓŠC=OĖ«¼ü£¬¹ŹAÖŠŗ¬ÓŠ-OH£¬ŗĖ“Ź²ÕńĒāĘ×ĻŌŹ¾AÖŠÓŠ5ÖÖĄąŠĶĒāŌ×ÓµÄĪüŹÕ·å£¬·åĆ껿֮±ČĪŖ3£ŗ3£ŗ2£ŗ1£ŗ1£¬¹ŹAĪŖ

£¬Óė±½¼×Ėį·¢Éśõ„»Æ·“Ӧɜ³ÉĻćĮĻX£¬¹ŹXĪŖ

£®A·¢ÉśŃõ»Æ·“Ӧɜ³ÉB£¬BĪŖ
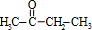
£¬ÓÉ·“Ó¦ŠÅĻ¢æÉÖŖ£¬
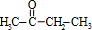
ÓėCH
3CH
2CH
2CH
2MgCl·¢Éś¼Ó³É·“Ӧɜ³ÉC£¬CŌŁĖ®½āÉś³ÉD£¬¹ŹDĪŖCH
3C£ØOH£©£ØC
2H
5£©CH
2CH
2CH
2CH
3£¬D·¢ÉśĻūČ„·“Ӧɜ³ÉE£Ø3-¼×»ł-3-øżĻ©£©£¬E½į¹¹¼ņŹ½ĪŖCH
3CH
2C£ØCH
3£©=CHCH
2CH
2CH
3£®ĒżĪĆ“¼µÄĆū³ĘĪŖ2-ŅŅ»ł-1£¬3-¼ŗ¶ž“¼£¬½į¹¹¼ņŹ½ĪŖHOCH
2CH£ØC
2H
5£©CH£ØOH£©CH
2CH
2CH
3£¬½įŗĻEÓėĒżĪĆ“¼µÄ½į¹¹”¢FµÄ·Ö×ÓŹ½æÉÖŖ£¬EŌŚøßĪĀ»ņ¹āÕÕĢõ¼žĻĀ£¬C=CÖŠ¼×»łÉĻHŌ×Ó±»BrŌ×ÓČ”“ś£¬¹ŹFĪŖCH
3CH
2C£ØCH
2Br£©=CHCH
2CH
2CH
3£¬FŌŚĒāŃõ»ÆÄĘĖ®ČÜŅŗ”¢¼ÓČČĢõ¼žĻĀ·¢ÉśĖ®½ā·“Ӧɜ³ÉG£¬GµÄ½į¹¹¼ņŹ½ĪŖCH
3CH
2C£ØCH
2OH£©=CHCH
2CH
2CH
3£¬G·¢Éś¼Ó³É·“Ӧɜ³ÉK£¬KĪŖCH
3CH
2C£ØCH
2Br£©CH£ØBr£©CH
2CH
2CH
3£¬KĒāŃõ»ÆÄĘĖ®ČÜŅŗ”¢¼ÓČČĢõ¼žĻĀ·¢ÉśĖ®½ā·“Ӧɜ³ÉĒżĪĆ“¼£¬
£Ø1£©ÓÉÉĻŹö·ÖĪöæÉÖŖ£¬AµÄ·Ö×ÓŹ½ŹĒ£¬½į¹¹¼ņŹ½ĪŖ

£¬ŗ¬ÓŠōĒ»ł£¬
¹Ź“š°øĪŖ£ŗC
4H
10O£¬ōĒ»ł£»
£Ø2£©·“Ó¦¢ŚŹĒCH
3C£ØOH£©£ØC
2H
5£©CH
2CH
2CH
2CH
3·¢ÉśĻūČ„·“Ӧɜ³ÉE£Ø3-¼×»ł-3-øżĻ©£©£¬¹Ź“š°øĪŖ£ŗĻūČ„·“Ó¦£»
£Ø3£©·“Ó¦¢ŁŹĒ

Óė±½¼×Ėį·¢Éśõ„»Æ·“Ӧɜ³É

£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗ

+


+H
2O£¬
¹Ź“š°øĪŖ£ŗ

+


+H
2O£»
£Ø4£©Ņ»¶ØĢõ¼žĻĀ£¬CH
3CH
2C£ØCH
2OH£©=CHCH
2CH
2CH
3·¢Éś¼Ó¾Ū·“Ӧɜ³ÉŅ»ÖÖøß·Ö×ÓŹ÷Ö¬£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗ
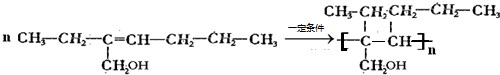
£¬
¹Ź“š°øĪŖ£ŗ
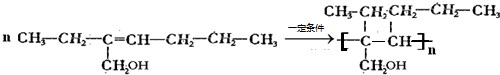
£»
£Ø5£©Č”ÉŁĮæÓŠ»śĪļK£¬·ÅÓŚŹŌ¹ÜÖŠ£¬¼ÓČėĒāŃõ»ÆÄĘČÜŅŗ¹²ČČ£¬Ņ»¶ĪŹ±¼äŗó£¬Č”³öÉĻ²ćĒåŅŗ£¬¼ÓĻ”ĻõĖįĖį»Æ£¬ŌŁ¼ÓČėĻõĖįŅų£¬ČōÓŠµ»ĘÉ«³ĮµķÉś³É£¬Ö¤Ć÷ÓŠäåŌŖĖŲ£¬
¹Ź“š°øĪŖ£ŗȔɣĮæÓŠ»śĪļK£¬·ÅÓŚŹŌ¹ÜÖŠ£¬¼ÓČėĒāŃõ»ÆÄĘČÜŅŗ¹²ČČ£¬Ņ»¶ĪŹ±¼äŗó£¬Č”³öÉĻ²ćĒåŅŗ£¬¼ÓĻ”ĻõĖįĖį»Æ£¬ŌŁ¼ÓČėĻõĖįŅų£¬ČōÓŠµ»ĘÉ«³ĮµķÉś³É£¬Ö¤Ć÷ÓŠäåŌŖĖŲ£»
£Ø6£©

µÄĶ¬·ÖŅģ¹¹ĢåÖŠ£¬1molÓŠ»śĪļæÉÓė2molĒāŃõ»ÆÄĘĖ®ČÜŅŗĶźČ«·“Ó¦µĆµ½Į½ÖÖÓŠ»ś²śĪļ£¬¹ŹĪŖōČĖįÓė·ÓŠĪ³ÉµÄõ„£¬±½»·ÉĻÓŠČżøöČ”“ś»ł£¬ĘäÖŠĮ½øöĪŖĻąĶ¬»łĶÅ£¬¹ŹČ”“ś»łĪŖ-OOCCH
2CH
3”¢2øö-CH
3»ņ
-OOCH”¢2øö-CH
2CH
3£¬Čō2øö-CH
3ĻąĮŚ£¬-OOCCH
2CH
3ÓŠ2ÖÖĪ»ÖĆ¹ŲĻµ£¬Čō2øö-CH
3Ļą¼ä£¬-OOCCH
2CH
3ÓŠ3ÖÖĪ»ÖĆ¹ŲĻµ£¬
Čō2øö-CH
3Ļą¶Ō£¬-OOCCH
2CH
3ÓŠ1ÖÖĪ»ÖĆ¹ŲĻµ£¬¹ŹÓŠ6ÖÖĶ¬·ÖŅģ¹¹Ģ壬Ķ¬ĄķČ”“ś»łĪŖ-OOCH”¢2øö-CH
2CH
3£¬ÓŠ6ÖÖĶ¬·ÖŅģ¹¹Ģ壬¹Ź·ūŗĻĢõ¼žµÄĶ¬·ÖŅģ¹¹ĢåÓŠ12ÖÖ£¬ĪŖ

µČ£¬¹Ź“š°øĪŖ£ŗ12£¬

£®


 £ØX“ś±ķĀ±Ō×Ó£©
£ØX“ś±ķĀ±Ō×Ó£© +
+
 +H2O
+H2O +
+
 +H2O
+H2O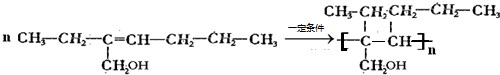
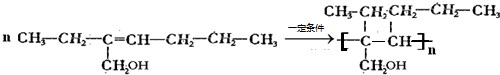


 £¬Óė±½¼×Ėį·¢Éśõ„»Æ·“Ӧɜ³ÉĻćĮĻX£¬¹ŹXĪŖ
£¬Óė±½¼×Ėį·¢Éśõ„»Æ·“Ӧɜ³ÉĻćĮĻX£¬¹ŹXĪŖ £®A·¢ÉśŃõ»Æ·“Ӧɜ³ÉB£¬BĪŖ
£®A·¢ÉśŃõ»Æ·“Ӧɜ³ÉB£¬BĪŖ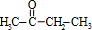 £¬ÓÉ·“Ó¦ŠÅĻ¢æÉÖŖ£¬
£¬ÓÉ·“Ó¦ŠÅĻ¢æÉÖŖ£¬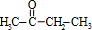 ÓėCH3CH2CH2CH2MgCl·¢Éś¼Ó³É·“Ӧɜ³ÉC£¬CŌŁĖ®½āÉś³ÉD£¬¹ŹDĪŖCH3C£ØOH£©£ØC2H5£©CH2CH2CH2CH3£¬D·¢ÉśĻūČ„·“Ӧɜ³ÉE£Ø3-¼×»ł-3-øżĻ©£©£¬E½į¹¹¼ņŹ½ĪŖCH3CH2C£ØCH3£©=CHCH2CH2CH3£®ĒżĪĆ“¼µÄĆū³ĘĪŖ2-ŅŅ»ł-1£¬3-¼ŗ¶ž“¼£¬½į¹¹¼ņŹ½ĪŖHOCH2CH£ØC2H5£©CH£ØOH£©CH2CH2CH3£¬½įŗĻEÓėĒżĪĆ“¼µÄ½į¹¹”¢FµÄ·Ö×ÓŹ½æÉÖŖ£¬EŌŚøßĪĀ»ņ¹āÕÕĢõ¼žĻĀ£¬C=CÖŠ¼×»łÉĻHŌ×Ó±»BrŌ×ÓČ”“ś£¬¹ŹFĪŖCH3CH2C£ØCH2Br£©=CHCH2CH2CH3£¬FŌŚĒāŃõ»ÆÄĘĖ®ČÜŅŗ”¢¼ÓČČĢõ¼žĻĀ·¢ÉśĖ®½ā·“Ӧɜ³ÉG£¬GµÄ½į¹¹¼ņŹ½ĪŖCH3CH2C£ØCH2OH£©=CHCH2CH2CH3£¬G·¢Éś¼Ó³É·“Ӧɜ³ÉK£¬KĪŖCH3CH2C£ØCH2Br£©CH£ØBr£©CH2CH2CH3£¬KĒāŃõ»ÆÄĘĖ®ČÜŅŗ”¢¼ÓČČĢõ¼žĻĀ·¢ÉśĖ®½ā·“Ӧɜ³ÉĒżĪĆ“¼£¬¾Ż“Ė½ā“š£®
ÓėCH3CH2CH2CH2MgCl·¢Éś¼Ó³É·“Ӧɜ³ÉC£¬CŌŁĖ®½āÉś³ÉD£¬¹ŹDĪŖCH3C£ØOH£©£ØC2H5£©CH2CH2CH2CH3£¬D·¢ÉśĻūČ„·“Ӧɜ³ÉE£Ø3-¼×»ł-3-øżĻ©£©£¬E½į¹¹¼ņŹ½ĪŖCH3CH2C£ØCH3£©=CHCH2CH2CH3£®ĒżĪĆ“¼µÄĆū³ĘĪŖ2-ŅŅ»ł-1£¬3-¼ŗ¶ž“¼£¬½į¹¹¼ņŹ½ĪŖHOCH2CH£ØC2H5£©CH£ØOH£©CH2CH2CH3£¬½įŗĻEÓėĒżĪĆ“¼µÄ½į¹¹”¢FµÄ·Ö×ÓŹ½æÉÖŖ£¬EŌŚøßĪĀ»ņ¹āÕÕĢõ¼žĻĀ£¬C=CÖŠ¼×»łÉĻHŌ×Ó±»BrŌ×ÓČ”“ś£¬¹ŹFĪŖCH3CH2C£ØCH2Br£©=CHCH2CH2CH3£¬FŌŚĒāŃõ»ÆÄĘĖ®ČÜŅŗ”¢¼ÓČČĢõ¼žĻĀ·¢ÉśĖ®½ā·“Ӧɜ³ÉG£¬GµÄ½į¹¹¼ņŹ½ĪŖCH3CH2C£ØCH2OH£©=CHCH2CH2CH3£¬G·¢Éś¼Ó³É·“Ӧɜ³ÉK£¬KĪŖCH3CH2C£ØCH2Br£©CH£ØBr£©CH2CH2CH3£¬KĒāŃõ»ÆÄĘĖ®ČÜŅŗ”¢¼ÓČČĢõ¼žĻĀ·¢ÉśĖ®½ā·“Ӧɜ³ÉĒżĪĆ“¼£¬¾Ż“Ė½ā“š£® £¬Óė±½¼×Ėį·¢Éśõ„»Æ·“Ӧɜ³ÉĻćĮĻX£¬¹ŹXĪŖ
£¬Óė±½¼×Ėį·¢Éśõ„»Æ·“Ӧɜ³ÉĻćĮĻX£¬¹ŹXĪŖ £®A·¢ÉśŃõ»Æ·“Ӧɜ³ÉB£¬BĪŖ
£®A·¢ÉśŃõ»Æ·“Ӧɜ³ÉB£¬BĪŖ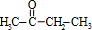 £¬ÓÉ·“Ó¦ŠÅĻ¢æÉÖŖ£¬
£¬ÓÉ·“Ó¦ŠÅĻ¢æÉÖŖ£¬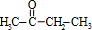 ÓėCH3CH2CH2CH2MgCl·¢Éś¼Ó³É·“Ӧɜ³ÉC£¬CŌŁĖ®½āÉś³ÉD£¬¹ŹDĪŖCH3C£ØOH£©£ØC2H5£©CH2CH2CH2CH3£¬D·¢ÉśĻūČ„·“Ӧɜ³ÉE£Ø3-¼×»ł-3-øżĻ©£©£¬E½į¹¹¼ņŹ½ĪŖCH3CH2C£ØCH3£©=CHCH2CH2CH3£®ĒżĪĆ“¼µÄĆū³ĘĪŖ2-ŅŅ»ł-1£¬3-¼ŗ¶ž“¼£¬½į¹¹¼ņŹ½ĪŖHOCH2CH£ØC2H5£©CH£ØOH£©CH2CH2CH3£¬½įŗĻEÓėĒżĪĆ“¼µÄ½į¹¹”¢FµÄ·Ö×ÓŹ½æÉÖŖ£¬EŌŚøßĪĀ»ņ¹āÕÕĢõ¼žĻĀ£¬C=CÖŠ¼×»łÉĻHŌ×Ó±»BrŌ×ÓČ”“ś£¬¹ŹFĪŖCH3CH2C£ØCH2Br£©=CHCH2CH2CH3£¬FŌŚĒāŃõ»ÆÄĘĖ®ČÜŅŗ”¢¼ÓČČĢõ¼žĻĀ·¢ÉśĖ®½ā·“Ӧɜ³ÉG£¬GµÄ½į¹¹¼ņŹ½ĪŖCH3CH2C£ØCH2OH£©=CHCH2CH2CH3£¬G·¢Éś¼Ó³É·“Ӧɜ³ÉK£¬KĪŖCH3CH2C£ØCH2Br£©CH£ØBr£©CH2CH2CH3£¬KĒāŃõ»ÆÄĘĖ®ČÜŅŗ”¢¼ÓČČĢõ¼žĻĀ·¢ÉśĖ®½ā·“Ӧɜ³ÉĒżĪĆ“¼£¬
ÓėCH3CH2CH2CH2MgCl·¢Éś¼Ó³É·“Ӧɜ³ÉC£¬CŌŁĖ®½āÉś³ÉD£¬¹ŹDĪŖCH3C£ØOH£©£ØC2H5£©CH2CH2CH2CH3£¬D·¢ÉśĻūČ„·“Ӧɜ³ÉE£Ø3-¼×»ł-3-øżĻ©£©£¬E½į¹¹¼ņŹ½ĪŖCH3CH2C£ØCH3£©=CHCH2CH2CH3£®ĒżĪĆ“¼µÄĆū³ĘĪŖ2-ŅŅ»ł-1£¬3-¼ŗ¶ž“¼£¬½į¹¹¼ņŹ½ĪŖHOCH2CH£ØC2H5£©CH£ØOH£©CH2CH2CH3£¬½įŗĻEÓėĒżĪĆ“¼µÄ½į¹¹”¢FµÄ·Ö×ÓŹ½æÉÖŖ£¬EŌŚøßĪĀ»ņ¹āÕÕĢõ¼žĻĀ£¬C=CÖŠ¼×»łÉĻHŌ×Ó±»BrŌ×ÓČ”“ś£¬¹ŹFĪŖCH3CH2C£ØCH2Br£©=CHCH2CH2CH3£¬FŌŚĒāŃõ»ÆÄĘĖ®ČÜŅŗ”¢¼ÓČČĢõ¼žĻĀ·¢ÉśĖ®½ā·“Ӧɜ³ÉG£¬GµÄ½į¹¹¼ņŹ½ĪŖCH3CH2C£ØCH2OH£©=CHCH2CH2CH3£¬G·¢Éś¼Ó³É·“Ӧɜ³ÉK£¬KĪŖCH3CH2C£ØCH2Br£©CH£ØBr£©CH2CH2CH3£¬KĒāŃõ»ÆÄĘĖ®ČÜŅŗ”¢¼ÓČČĢõ¼žĻĀ·¢ÉśĖ®½ā·“Ӧɜ³ÉĒżĪĆ“¼£¬ £¬ŗ¬ÓŠōĒ»ł£¬
£¬ŗ¬ÓŠōĒ»ł£¬ Óė±½¼×Ėį·¢Éśõ„»Æ·“Ӧɜ³É
Óė±½¼×Ėį·¢Éśõ„»Æ·“Ӧɜ³É £¬·“Ó¦·½³ĢŹ½ĪŖ£ŗ
£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗ +
+
 +H2O£¬
+H2O£¬ +
+
 +H2O£»
+H2O£»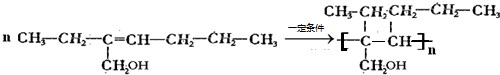 £¬
£¬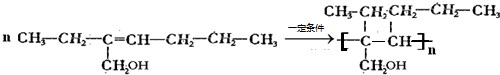 £»
£» µÄĶ¬·ÖŅģ¹¹ĢåÖŠ£¬1molÓŠ»śĪļæÉÓė2molĒāŃõ»ÆÄĘĖ®ČÜŅŗĶźČ«·“Ó¦µĆµ½Į½ÖÖÓŠ»ś²śĪļ£¬¹ŹĪŖōČĖįÓė·ÓŠĪ³ÉµÄõ„£¬±½»·ÉĻÓŠČżøöČ”“ś»ł£¬ĘäÖŠĮ½øöĪŖĻąĶ¬»łĶÅ£¬¹ŹČ”“ś»łĪŖ-OOCCH2CH3”¢2øö-CH3»ņ
µÄĶ¬·ÖŅģ¹¹ĢåÖŠ£¬1molÓŠ»śĪļæÉÓė2molĒāŃõ»ÆÄĘĖ®ČÜŅŗĶźČ«·“Ó¦µĆµ½Į½ÖÖÓŠ»ś²śĪļ£¬¹ŹĪŖōČĖįÓė·ÓŠĪ³ÉµÄõ„£¬±½»·ÉĻÓŠČżøöČ”“ś»ł£¬ĘäÖŠĮ½øöĪŖĻąĶ¬»łĶÅ£¬¹ŹČ”“ś»łĪŖ-OOCCH2CH3”¢2øö-CH3»ņ µČ£¬¹Ź“š°øĪŖ£ŗ12£¬
µČ£¬¹Ź“š°øĪŖ£ŗ12£¬ £®
£®


