
分析 (1)25℃时,0.1mol/L氨水溶液中存在NH3.H2O?NH4++OH-,水的电离程度很小,所以溶液中水电离出的C(OH-)可以忽略不计,则C(OH-)=$\sqrt{K.C(N{H}_{3}.{H}_{2}O)}$,溶液中C(H+)=$\frac{Kw}{c(O{H}^{-})}$,pH=-lgc(H+);
(2)根据c(NH3•H2O)=$\frac{{c}^{2}(O{H}^{-})}{{K}_{b}}$计算.
解答 解:(1)25℃时,0.1mol/L氨水溶液中存在NH3.H2O?NH4++OH-,水的电离程度很小,所以溶液中水电离出的C(OH-)可以忽略不计,则c(OH-)=$\sqrt{K.C(N{H}_{3}.{H}_{2}O)}$=$\sqrt{1.75×1{0}^{-5}×0.1}$mol/L=1.3×10-3 mol.L -1,
答:0.1mol/L的氨水中c(OH-)是1.3×10-3 mol.L -1;
(2)c(NH3•H2O)=$\frac{{c}^{2}(O{H}^{-})}{{K}_{b}}$=$\frac{(0.01mol/L)^{2}}{1.75×1{0}^{-5}}$=5.7mol/L;
答:c(NH3•H2O)为5.7mol/L.
点评 本题考查pH的简单计算、电离常数在计算中的应用,侧重考查分析计算能力,明确弱酸、弱碱中氢离子浓度或氢氧根离子浓度的计算方法是解本题关键,题目难度不大.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | NaOH固体置于大小相同的滤纸上称量 | |
| B. | 蒸馏操作时,冷凝水的方向须与气体的流向相同 | |
| C. | 配制稀硫酸时,将浓硫酸溶解后直接转移入容量瓶 | |
| D. | 分液时,先要打开分液漏斗上口活塞,再打开旋塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
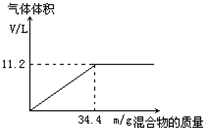 在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应.如图表示加入的混合物的质量与产生的气体体积(标准状况)的关系.
在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应.如图表示加入的混合物的质量与产生的气体体积(标准状况)的关系.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相关信息 | |
| X | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得X的单质 |
| Y | 含Y元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R元素原子的最外层电子数是K层电子数的3倍 |
 ;
; ,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.
,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①②⑤⑥⑦ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系 能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
| A. | 容器②中达平衡时放出的热量Q=23.15 kJ | |
| B. | 平衡时,两个容器中NH3的体积分数均为$\frac{1}{7}$ | |
| C. | 容器①、②中反应的平衡常数相等 | |
| D. | 若容器①体积为0.5L,则平衡时放出的热量<23.15kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com