
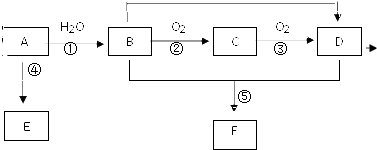
 已知 A 的产量通常用来衡量一个国家的石油化工水平,现以 A 为主要原料合成高分子化合物 E 和一种具有果香味的物质 F,其合成路线如图所示.
已知 A 的产量通常用来衡量一个国家的石油化工水平,现以 A 为主要原料合成高分子化合物 E 和一种具有果香味的物质 F,其合成路线如图所示.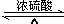 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.分析 A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,CH2=CH2与水发生加成反应生成B为CH3CH2OH,CH3CH2OH在Cu或Ag作催化剂条件下,发生催化氧化生成C为CH3CHO,CH3CHO进一步氧化生成D为CH3COOH,CH3COOH与CH3CH2OH发生酯化反应生成E为CH3COOC2H5,乙烯发生加聚反应生成E为 ,据此解答.
,据此解答.
解答 解:A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,CH2=CH2与水发生加成反应生成B为CH3CH2OH,CH3CH2OH在Cu或Ag作催化剂条件下,发生催化氧化生成C为CH3CHO,CH3CHO进一步氧化生成D为CH3COOH,CH3COOH与CH3CH2OH发生酯化反应生成E为CH3COOC2H5,乙烯发生加聚反应生成E为 .
.
(1)工业上由石蜡制取 乙烯 的方法称作:裂解,
故答案为:裂解;
(2)反应⑤是乙酸与乙醇发生酯化反应生成乙酸乙酯,反应方程式为:CH3COOH+CH3CH2OH 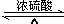 CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
故答案为:CH3COOH+CH3CH2OH 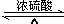 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
(3)A为乙烯,E为聚乙烯,
a.乙烯含有碳碳双键,能使溴水褪色,而聚乙烯没有碳碳双键,不能是溴水褪色,故a错误;
b.乙烯与聚乙烯中均含有碳碳键,碳氢键,碳碳键属于非极性键,故b错误;
c.乙烯与聚乙烯的最简式均为CH2,故c正确;
d.聚乙烯中聚合度n不同,均混合物,故d错误.
故选:c;
(4)由CH3CH2OH、O2 和 KOH 溶液组成的燃料电池,负极发生氧化反应,乙醇在负极失去电子,进行条件下生成碳酸根与水,负极反应式:CH3CH2OH-12e-+16OH-=2CO32-+11H2O,
故答案为:CH3CH2OH-12e-+16OH-=2CO32-+11H2O.
点评 本题考查有机物推断、有机物的结构与性质等,涉及烯烃、醇、酸、羧酸、酯的性质与转化,比较基础,有利于基础知识的巩固.


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:多选题
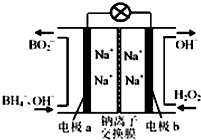 据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示,下列说法正确的是( )
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示,下列说法正确的是( )| A. | 电池放电时Na+从a极区移向b极区 | |
| B. | 电极a采用MnO2,放电时它被还原 | |
| C. | 该电池负极的电极反应式为:BH4-+8OH--8e-═BO2-+6H2O | |
| D. | 放电时,a极区的电极反应生成碱,碱性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,100g46%乙醇水溶液中含有H原子数为12 NA | |
| B. | 23gNa与足量O2反应,生成Na2O 和Na2O2的混合物,转移的电子数为 NA | |
| C. | 标准状况下,2.24 LCCl4含有的共价键数为0.4 NA | |
| D. | 1 molN2与4molH2反应生成的NH3分子数小于2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
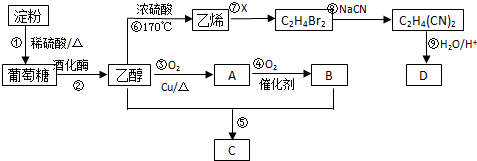
 CH3COOCH2CH3+H2O.反应⑥用于实验室制乙烯,为除去其中可能混有的SO2应选用的试剂是NaOH溶液.
CH3COOCH2CH3+H2O.反应⑥用于实验室制乙烯,为除去其中可能混有的SO2应选用的试剂是NaOH溶液.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应 | |
| B. | 足量的Fe在Cl2中燃烧生成FeCl2和FeCl3 | |
| C. | 先后将等物质的量的Fe2O3和Fe分别溶于同一稀盐酸时无气体放出 | |
| D. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3,在给定的条件下能实现转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
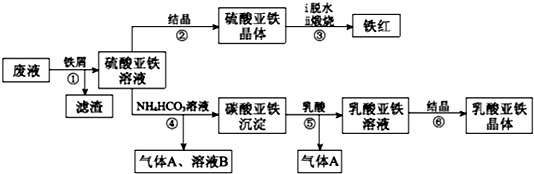
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com