
| A. | 1molFe溶于硝酸,电子转移数为3NA | |
| B. | 12.0gNaHSO4固体中含阳离子数为0.1NA | |
| C. | 标准状态下,22.4L氟化氢中含有氟原子数为NA | |
| D. | 7.8gNa2O2与足量的水反应转移电子数为0.2NA |
分析 A、铁对于硝酸是过量还是不足不明确;
B、求出硫酸氢钠的物质的量,然后根据硫酸氢钠中含1个钠离子和1个硫酸氢根来分析;
C、标况下HF为液态;
D、求出过氧化钠的物质的量,然后根据过氧化钠和水反应时,1mol过氧化钠转移1mol电子来分析.
解答 解:A、铁对于硝酸是过量还是不足不明确,即铁反应后变为+2价还是+3价不明确,则转移的电子数不明确,故A错误;
B、12.0g硫酸氢钠的物质的量为0.1mol,而硫酸氢钠中含1个钠离子和1个硫酸氢根,故0.1mol硫酸氢钠固体中含0.1NA个阳离子,故B正确;
C、标况下HF为液态,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、7.8g过氧化钠的物质的量为0.1mol,而过氧化钠和水反应时,1mol过氧化钠转移1mol电子,故0.1mol过氧化钠转移0.1NA个电子,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题

| A. | ①③④ | B. | ①④ | C. | ②③⑤ | D. | 除② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化亚铁和稀盐酸反应:FeS+2H+=Fe2++H2S↑ | |
| B. | 次氯酸钠溶液中通入少量SO2反应:SO2+H2O+ClO-=SO42-+Cl-+2H+ | |
| C. | 过氧化钠加入足量稀硫酸反应:2Na2O2+4H+═4Na++O2↑+2H2O | |
| D. | 铜粉中加入溴化铁溶液反应:2Fe3++Cu=2Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
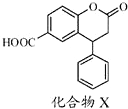
| A. | 分子式为C16H14O4 | |
| B. | 1mol化合物X在一定条件下最多加成6molH2 | |
| C. | 分子中有三种官能团,酸性条件下水解后官能团还是三种 | |
| D. | 1mol化合物X最多能与2molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 用激光笔分别照射蛋白质溶液、硅酸溶胶 | 将二者区别开 |
| B | 将C2H5OH与浓H2SO4在蒸馏烧瓶中混合后加热至 170℃,烧瓶内逸出的物质通入到酸性KMnO4溶液中 | 检验有无乙烯生成 |
| C | 将Al(OH)3置于适量0.2mol•L-1 FeCl3溶液中,-段时间后可得到红褐色固体 | 溶度积:Ksp[AL(OH)3]>Ksp[Fe(OH)3] |
| D | 向蔗糖溶液中加入适量稀硫酸,水浴加热几分钟,然后加入新制的银氨溶液,并水浴加热 | 检验蔗糖的水解产物是否具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学方程式 | 反应类型 |
| A | 4Fe(OH)2+O2+2H2O=4Fe(OH)3 | 化合反应 |
| B | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | 分解反应 |
| C | BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2 | 复分解反应 |
| D | Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 | 置换反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质是由一种元素组成的物质,则由一种元素组成的物质一定是单质 | |
| B. | 氧元素与硫元素原子的最外层电子数相同,所以二者具有相似的化学性质 | |
| C. | 溶液中有晶体析出,其溶质质量减小,所以溶质的质量分数一定减小 | |
| D. | 碱溶液能使酚酞试液变红,滴入酚酞试液后变红的一定是碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
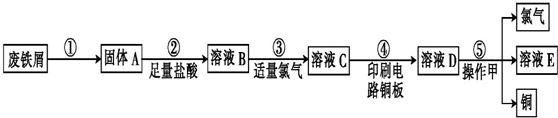
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com