
| A. | ①②③ | B. | ②③④ | C. | ②③⑥ | D. | ②⑤⑥ |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
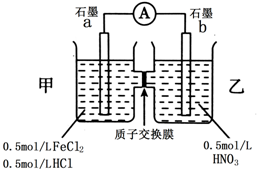
科目:高中化学 来源: 题型:解答题
 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99 kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99 kJ•mol-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+$\frac{1}{2}$ O2(g)═H2O(g)△H=+242 kJ/mol | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$ O2(g)═H2O(g)△H=-242kJ/mol | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
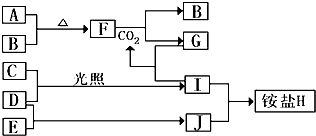
 和
和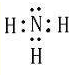 .
.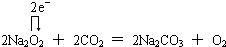 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀盐酸反应:Fe+2H+=Fe2++H2↑ | |
| B. | 氨水与盐酸反应:OH-+H+=H2O | |
| C. | 锌与硫酸铜溶液反应:Zn+Cu2+=Zn2++Cu | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com