
| A. | 标准状况下,1 L苯所含有的分子数为$\frac{{N}_{A}}{22.4}$ | |
| B. | 1 mol甲基(-CH3)所含电子数为9NA | |
| C. | 标准状况下,22.4 LC2H4的质量为28克 | |
| D. | 26 g C2H2和苯蒸气的混合气体中所含的C原子数为2NA |
分析 A、标况下苯为液态;
B、甲基含9个电子;
C、质量m=$\frac{V}{{V}_{m}}M$;
D、乙炔和苯的最简式均为CH;
解答 解:A、标况下苯为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故A错误;
B、甲基含9个电子,故1mol甲基中含9NA个电子,故B正确;
C、质量m=$\frac{V}{{V}_{m}}M$=$\frac{22.4L}{22.4L/mol}×28g/mol$=28g,故C正确;
D、乙炔和苯的最简式均为CH,故26g混合物中含有的CH的物质的量为n=$\frac{26g}{13g/mol}$=2mol,故含2NA个碳原子,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
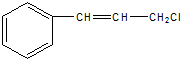 中官能团的名称:碳碳双键、氯原子.
中官能团的名称:碳碳双键、氯原子.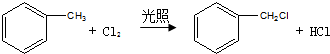 .
.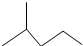 所表示物质的名称是:2-甲基戊烷.
所表示物质的名称是:2-甲基戊烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数d>c>b>a | B. | 离子半径C2->D->B+>A2+ | ||
| C. | 原子半径A>B>C>D | D. | 非金属性:C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40 |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量SO2通入CaCl2溶液能生成白色沉淀 | |
| B. | 可以用澄清石灰水鉴别SO2和CO2 | |
| C. | 硫粉在过量的纯氧中燃烧可以生成SO3 | |
| D. | SO2能使FeCl3、KMnO4水溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol•L-1 | B. | 0.2 mol•L-1 | C. | 0.02mol•L-1 | D. | 20 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数A>B>C>D | B. | 原子半径D>C>A>B | ||
| C. | 氢化物的稳定性H2D>HC | D. | 碱性的强弱AOH>B(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
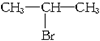 (主要产物),1mol某烃A充分燃烧后得到8mol CO2和4mol H2O.
(主要产物),1mol某烃A充分燃烧后得到8mol CO2和4mol H2O.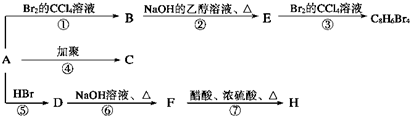
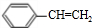 .
.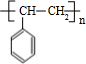
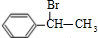 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$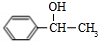 +NaBr
+NaBr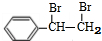 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$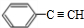 +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
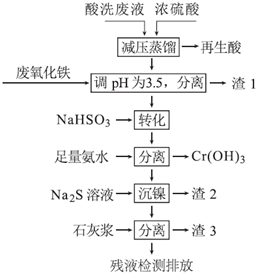
| Fe3+ | Ni2+ | Cr3+ | |
| 开始沉淀 | 1.5 | 6.7 | 4.0 |
| 沉淀完全 | 3.4 | 9.5 | 6.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com