
根据已学知识,请你回答下列问题:
(1)写出原子序数最小的第Ⅷ族元素原子的原子结构示意图为: .
(2)写出3p轨道上有2个未成对电子的元素的符号: .
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是 .
(4)根据VSEPR模型,H3O+的分子立体结构为: ,SO2的立体结构为: .
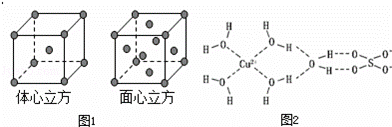
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图1所示.则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为 ;若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为 .
(6)胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图2,其中配位键和氢键均采用虚线表示.
①写出基态Cu原子的核外电子排布式: 1s22s22p63s23p63d104s1或[Ar]3d104s1 ②写出胆矾晶体中水合铜离子的结构简式(用配位键表示): .
(7)决定离子空间结构的因素有 、 和离子键的纯粹程度.
考点:
晶胞的计算;原子结构与元素的性质;配合物的成键情况.
专题:
化学键与晶体结构.
分析:
(1)第Ⅷ族元素有铁、钴、镍,原子序数最小的是铁,原子核外有26个电子,根据原子结构示意图的书写规则书写;
(2)3p轨道上有2个未成对电子时有两种情况,一种是另一个3p轨道上没有电子,一种是另一个3p轨道上充满电子,写出相应的元素符号;
(3)根据原子的外围电子排布是4s24p4,确定该原子名称;
(4)根据VSEPR模型,计算价层电子对数,据此判断分子空间构型;
(5)利用均摊法计算晶胞中含有的原子个数;晶胞的密度等于晶胞中铁原子的质量与体积的比.
(6)①铜是29号元素,其原子核外有29个电子,根据构造原理书写其基态原子核外电子排布式;
②CuSO4•5H2O中铜离子含有空轨道,水分子含有孤对电子对,铜离子与水分子之间形成配位键,铜离子配体数为4;
(7)根据离子晶体的晶体类型分析.
解答:
解:(1)第Ⅷ族元素有铁、钴、镍,原子序数最小的是铁,原子核外有26个电子,其原子结构示意图为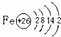 ,故答案为:
,故答案为: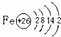 ;
;
(2)3p轨道上有2个未成对电子时有两种情况,一种是另一个3p轨道上没有电子,一种是另一个3p轨道上充满电子,所以当另一个3p轨道上没有电子,该原子是Si;一种是另一个3p轨道上充满电子,该原子是S,故答案为:Si或S;
(3)原子的外围电子排布是4s24p4,说明该原子中各个轨道都充满电子,该原子核外电子数是34,所以是硒元素,故答案为:硒;
(4)根据VSEPR模型得,H3O+的价层电子对=3+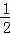 (6﹣1﹣3×1)=4,有1个孤电子对,所以是三角锥形;SO2的价层电子对=2+
(6﹣1﹣3×1)=4,有1个孤电子对,所以是三角锥形;SO2的价层电子对=2+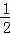 (6﹣2×2)=3,有1个孤电子对,所以是V形,
(6﹣2×2)=3,有1个孤电子对,所以是V形,
故答案为:三角锥形;V形;
(5)体心立方晶胞中铁原子个数=1+8×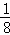 =2;面心立方晶胞中实际含有的Fe原子个数=6×
=2;面心立方晶胞中实际含有的Fe原子个数=6×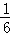 +8×
+8×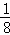 =4,所以体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比1:2;
=4,所以体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比1:2;
设体心立方中晶胞的棱长为x,铁原子的直径为A,则3x2=(2A)2,解得x=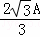 ;
;
铁原子直径=A,所以其晶胞体积=R3,面心立方中晶胞的对角线为2A,则其边长=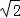 A,其晶胞体积=2
A,其晶胞体积=2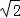 A3.
A3.
体心立方的密度与面心立方的密度之比=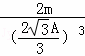 :
: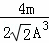 =3
=3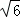 :8,故答案为:1:2; 3
:8,故答案为:1:2; 3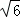 :8.
:8.
(6)①铜是29号元素,其原子核外有29个电子,根据构造原理知,其基态原子核外电子排布式为:1s22s22p63s23p63d104s1或[Ar]3d104s1,
故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;
②CuSO4•5H2O中铜离子含有空轨道,水分子含有孤对电子对,铜离子与水分子之间形成配位键,铜离子配体数为4.水合铜离子的结构简式为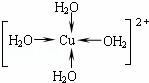 ,故答案为:
,故答案为: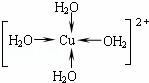 ;
;
(7)决定离子空间结构的因素有有三个方面:几何因素、电荷因素、离子键的纯粹程度,故答案为:几何因素;电荷因素.
点评:
本题考查了原子结构示意图的书写、微粒的空间构型的判断、晶胞的密度、原子核外电子排布式的书写、配位键的表示方法等知识点,难点是计算晶胞的密度,能正确解答晶胞的体积是解本题的关键,知道体心立方和面心立方中哪三个原子紧密相连即可分析解答,难度较大.


科目:高中化学 来源: 题型:
反应C(s)+H2O(g)⇌CO(g)+H2(g)在一固定容积的密闭容器中进行,下列条件的改变对其反应速率有影响的是( )
|
| A. | 减少H2O的浓度 | B. | 加入催化剂 |
|
| C. | 增加C的用量 | D. | 升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 1molNa2O2晶体中阴离子与阳离子之比为1:1 |
|
| B. | 1molSi晶体中含4molSi﹣Si键 |
|
| C. | 60gSiO2中含Si﹣O键的个数为4NA |
|
| D. | 12 g金刚石中含有C﹣C键的个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项所述的数字不是6的是( )
|
| A. | 在NaCl晶体中,与一个Na+最近的且距离相等的Cl﹣的个数 |
|
| B. | 在金刚石晶体中,最小的环上的碳原子个数 |
|
| C. | 在二氧化硅晶体中,最小的环上的原子个数 |
|
| D. | 在NaCl晶体中,与一个Cl﹣最近的且距离相等的Na+的个数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图曲线a表示放热反应 X(g)+Y(g)⇌Z(g)+M(g)+N(s)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
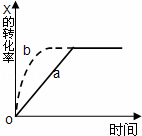
|
| A. | 升高温度 | B. | 加大X的投入量 |
|
| C. | 加催化剂 | D. | 增大体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在氨水中存在下列电离平衡:NH3•H2O⇌NH4++OH﹣,下列情况能引起电离平衡向正向移动的有( )
①加NH4Cl固体 ②加NaOH溶液 ③加HCl ④加CH3COOH溶液 ⑤加水 ⑥加压.
|
| A. | ①③⑤ | B. | ①④⑥ | C. | ③④⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
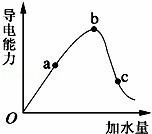
如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答.
(1)“O”点为什么不导电 .
(2)a、b、c三点的氢离子浓度由小到大的顺序为 .
(3)a、b、c三点中,醋酸的电离程度最大的一点是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列根据反应原理设计的应用,不正确的是 ( )。
A.CO +H2OHCO
+H2OHCO +OH- 用热的纯碱溶液清洗油污
+OH- 用热的纯碱溶液清洗油污
B.Al3++3H2OAl(OH)3+3H+ 明矾净水
C.TiCl4+(x+2)H2O(过量)TiO2·xH2O↓+4HCl制备TiO2纳米粉
D.SnCl2+H2OSn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com