
 计算v(CH4),再利用速率之比等于化学计量数之比计算v(CO);
计算v(CH4),再利用速率之比等于化学计量数之比计算v(CO);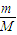 计算铜的物质的量,根据电子转移守恒可知,转移电子等于铜离子转化为铜获得的电子,再根据N=nNA计算注意电子数目.
计算铜的物质的量,根据电子转移守恒可知,转移电子等于铜离子转化为铜获得的电子,再根据N=nNA计算注意电子数目.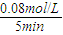 =0.016mol/(L?min),根据速率之比等于化学计量数之比,所以v(CO)=2v(CH4)=2×0.16mol/(L?min)=0.032mol/(L?min),
=0.016mol/(L?min),根据速率之比等于化学计量数之比,所以v(CO)=2v(CH4)=2×0.16mol/(L?min)=0.032mol/(L?min),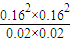 =1.64
=1.64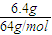 =0.1mol,根据电子转移守恒可知,转移电子等于铜离子转化为铜获得的电子,故转移电子数目为0.1mol×2×NAmol-1=0.2NA,
=0.1mol,根据电子转移守恒可知,转移电子等于铜离子转化为铜获得的电子,故转移电子数目为0.1mol×2×NAmol-1=0.2NA,

科目:高中化学 来源:2012-2013学年江苏泰州二中高二上学期期中考试化学(选修)试卷(带解析) 题型:填空题
(12分)Ⅰ.煤燃烧的反应热可通过以下两个途径来利用:a. 利用煤在充足的空气中直接燃烧产生的反应热;b. 先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
C(s)+O2(g)=CO2(g); ΔH=E1 ①
C(s)+H2O(g)=CO(g)+H2(g) ΔH=E2 ②
H2(g)+1/2O2(g)=H2O(g); ΔH=E3 ③
CO(g)+1/2O2(g)=CO2(g); ΔH=E4 ④,
试回答下列问题
(1)与途径a相比,途径b有较多的优点,即 。
(2)上述四个热化学方程式中ΔH>0的反应有 。
(3)等质量的煤分别通过以上两条不同途径产生的可利用的总能量关系正确的是 。
| A.a比b多 | B.a比b少 | C. a与b在理论上相同 | D.两者无法比较 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省武汉市高三二月调研测试理科综合化学试卷(解析版) 题型:填空题
目前,消除氮氧化物污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出CH4 (g)与NO2 (g)反应生成N2 (g) ,CO2(g)和H2O(l)的热化学方程 式_____________________
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)  N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T。C)条件下反应,反应进行到不同时间测得各物质的浓度如下
N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T。C)条件下反应,反应进行到不同时间测得各物质的浓度如下
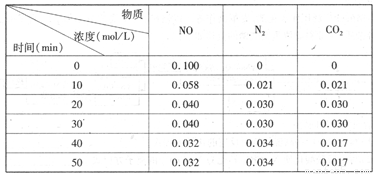
①不能作为判断反应达到化学平衡状态的依据 是_______
A.容器内CO2的浓度保持不变
B.v正(N2)=2 v正(NO)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②在T。C时.该反应的平衡常数为_______(保留两位小数);
③在30 min,改变某一条件,反应重新达到平衡,则改变的条件是_______
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:
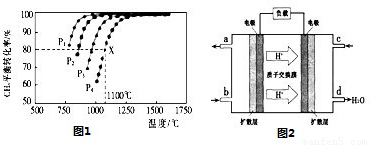
2CO+2NO  N2+2CO2 ΔH<0 研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反 应速率的影响规律、某同学设计了三组实验,部分实验条件已经填在下表中。
N2+2CO2 ΔH<0 研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反 应速率的影响规律、某同学设计了三组实验,部分实验条件已经填在下表中。

①上表中:a=_______,b=________,e=________
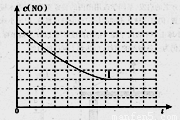
②请在给出的坐标图中,画出上表中实验II和实验III条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明相应的实验编号
查看答案和解析>>
科目:高中化学 来源:2014届江苏泰州二中高二上学期期中考试化学(选修)试卷(解析版) 题型:填空题
(12分)Ⅰ.煤燃烧的反应热可通过以下两个途径来利用:a. 利用煤在充足的空气中直接燃烧产生的反应热;b. 先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
C(s)+O2(g)=CO2(g); ΔH=E1 ①
C(s)+H2O(g)=CO(g)+H2(g) ΔH=E2 ②
H2(g)+1/2O2(g)=H2O(g); ΔH=E3 ③
CO(g)+1/2O2(g)=CO2(g); ΔH=E4 ④,
试回答下列问题
(1)与途径a相比,途径b有较多的优点,即 。
(2)上述四个热化学方程式中ΔH>0的反应有 。
(3)等质量的煤分别通过以上两条不同途径产生的可利用的总能量关系正确的是 。
A.a比b多 B. a比b少 C. a与b在理论上相同 D. 两者无法比较
Ⅱ.氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247.4 kJ·mol-1
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.煤燃烧的反应热可通过以下两个途径来利用:a. 利用煤在充足的空气中直接燃烧产生的反应热;b. 先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
C(s)+O2(g)=CO2(g); ΔH=E1 ①
C(s)+H2O(g)=CO(g)+H2(g) ΔH=E2 ②
H2(g)+1/2O2(g)=H2O(g); ΔH=E3 ③
CO(g)+1/2O2(g)=CO2(g); ΔH=E4 ④,
试回答下列问题
(1)与途径a相比,途径b有较多的优点,即________。
(2)上述四个热化学方程式中ΔH>0的反应有________。
(3)等质量的煤分别通过以上两条不同途径产生的可利用的总能量关系正确的是________。
| A.a比b多 | B.a比b少 | C. a与b在理论上相同 | D.两者无法比较 |
Ⅱ.氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247.4 kJ·mol-1
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com